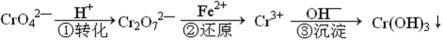- 化学平衡状态的判断
- 共46题
一定条件下,将3molA和1molB两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g) 
正确答案
解析
略。
知识点
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
其中第①步存在平衡:2CrO42—(黄色)+2H+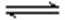
(1) 若平衡体系的pH=2,则溶液显 ___________ 色.
(2) 能说明第①步反应达平衡状态的是 ____________ 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) =v (CrO42—)
c.溶液的颜色不变 d. 溶液的pH值不变
(3) 第②步中,还原0.01mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(4) 许多过渡(金属)元素的氢氧化物在水中有两种电离方式,Cr(OH)3在溶液中存在以下平衡:H+ + CrO2—(亮绿色) + H2O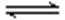
下列有关说法中正确的是
a、加酸则平衡向右移动,则生成Cr3+盐,加碱则平衡向左移动,生成亚铬酸盐(CrO2—)
b、在一定条件下存在:Cr(OH)3 + OH— → CrO2— + 2H2O ;Cr(OH)3 + 3H+ → Cr3+ + 3H2O
c、Cr3+盐中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d、Cr(OH)3(固)在水中的存在叁个平衡
正确答案
(1)橙
(2)cd
(3)0.06
(4)ab
解析
略
知识点
在三种不同条件下,分别向容积为2L的恒容容器中加入2molA和1molB,发生反应如下:2A(g)+B(g) 
正确答案
解析
略。
知识点
28.工业上“固定”和利用CO2能有效地减轻“温室’效应。有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g) 
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是()
A. n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
D.容器内的密度保持不变
(2)一定温度时将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6 mol。
① a点正反应速率()逆反应速率(填“大于”、“等于”或“小于”)。
② 仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验条件改变是(),曲线Ⅱ对应的实验条件改变是()。
③ 在题给图中绘出加入催化剂对应的曲线。
④ 结合图给实线的数据,计算该温度时反应的化学平衡常数。(写出计算过程)
(3)甲醇可用以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为()。
正确答案
见解析。
解析
(1) BC(3分,只选B或C得1分,全对得3分,凡其它有错答案不得分)
(2) ① 大于② 升高温度 增大压强
③
④
(3)CH3OH+8OH--6e-=CO32-+ 6H2O( 2分,未配平扣1分)
知识点
28.工业上“固定”和利用CO2能有效地减轻“温室’效应。有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g) 
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是_________。
A. n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
D.容器内的密度保持不变
(2)一定温度时将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6 mol。
① a点正反应速率_________逆反应速率(填“大于”、“等于”或“小于”)。
② 仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验条件改变是_________,曲线Ⅱ对应的实验条件改变是_________ 。
③ 在题给图中绘出加入催化剂对应的曲线。
④ 结合图给实线的数据,计算该温度时反应的化学平衡常数。(写出计算过程)
(3)甲醇可用以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:_________ 。
正确答案
见解析。
解析
(1) BC
(2) ① 大于;
② 升高温度 ;增大压强
③
④
(3)CH3OH+8OH--6e-=CO32-+ 6H2O
知识点
扫码查看完整答案与解析