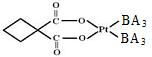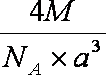- 化学方程式的书写
- 共78题
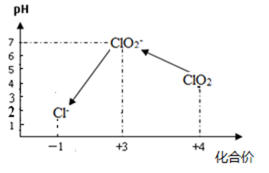
ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有 性。
(2)工业上可以通过下列方法制取ClO2,请完成该反应化学方程式:
2KClO3+ SO2 = 2ClO2 + 。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg/L之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ. 取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ. 加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2 ═ S4O62-+2I-)
Ⅲ. 加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示:
请回答:
① 操作Ⅰ中反应的离子方程式是 。
② 确定操作Ⅱ完全反应的现象是 。
③ 在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是 。
④ 若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3 mol/L 的Na2S2O3溶液10mL,则水样中ClO2的浓度是 mg/L。
正确答案
见解析。
解析
(1)氧化
(2)K2SO4
(3)
① 2ClO2+2I- =2ClO2-+I2
② 蓝色消失,半分钟内不变色
③ ClO2-+4I- +4H+=Cl-+2I2+2H2O
④ 0.675
知识点
Ⅰ.氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:
有关物质在水中溶解度分别为:
氯化铵:10℃时33.3g、20℃时37.2g、30℃时41.4g;氟化钠:20℃时4g;氟硅酸钠微溶于水。
请回答下列问题:
(1)上述流程中发生两步化学反应,第一步反应的化学方程式为: ,
第二步反应能进行是因为 。
(2)操作Ⅰ需要用到的玻璃仪器除玻璃棒外,还有 。
(3)操作II的作用是 。
(4)操作Ⅲ的具体过程是 。
(5)流程中NH4HCO3必须过量,其原因是 。
Ⅱ.硅实际上不易溶于单独的硝酸及氢氟酸。为了溶解硅制备H2SiF6,可使用浓硝酸和氢氟酸的混合物。此时,二氧化硅能很好地溶于氢氟酸。
(6)解释在硅的溶解过程中,硝酸和氢氟酸各起的作用分别是 、
。写出反应方程式 。
正确答案
(1)H2SiF6+6NH4HCO3=6NH4F+H2SiO3↓+6CO2↑+3H2O
NaF比NaCl的溶解性小
(2)烧杯、漏斗
(3)除去NaF、NH4Cl表面的杂质
(4)加热蒸发溶剂,析出多量固体后冷却
(5)必须保证H2SiF6能全部反应,防止在进行反应Ⅱ时H2SiF6将与NaCl反应,生成Na2SiF6沉淀,混入NaF中影响NaF质量
(6)硝酸是氧化剂,氢氟酸是配合剂
Si+4HNO3+6HF=H2SiF6+4NO2↑+4H2O
解析
略
知识点
已知A、B为单质,C为化合物。能实现下述转化关系的是
①若C溶于水后得到强碱溶液,则A可能是Na
②若C溶液遇Na2CO3,放出CO2气体,则A可能是H2
③若C溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
正确答案
解析
略
知识点
日常生活中的“电子垃圾”经科学处理后,可有效回收Cu、Al、Fe、Au、Pt等金属。下图是某化学兴趣小组设计的利用电子垃圾(含70%Cu、25%Al、4%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线:
已知下列信息:
(I) Cu可与稀硫酸和H2O2的混合液反应生成硫酸铜。
(II) 铁、铝、铜等离子以氢氧化物形式沉淀式溶液的pH如下表:
请回答下列问题:
(1)写出Cu与稀硫酸和H2O2的混合液反应的化学方程式:________。
(2)在操作2中,x的取值范围是________。
(3)在操作3中,蒸发浓缩需要的玻璃仪器有________。
(4)由滤渣2制取Al2(S04)3•18H2O,探究小组设计了三种方案:
综合考虑上述三种方案, 最具可行性的是________。
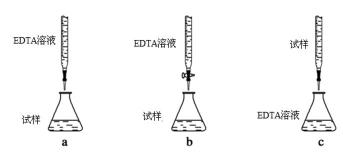
(5)为测定CuSO4 ·5H2O晶体的纯度,进行下列实验:取 a g试样配成100 mL溶液,每次取20.00mL,消除干扰离子后,用b mol。L-1 EDTA(Na2H2Y)标准溶液滴定其中的Cu 2+ (离子方程式为Cu 2+ + H2Y2- = Cu Y2- + 2H+),滴定至终点,平均消耗EDTA溶液12.00 mL。(常温时,5%的Na2H2Y水溶液,其pH为4~6)
①CuSO4 ·5H2O晶体的纯度是________。
②下列滴定方式中,最合理的是 (夹持部分略去)________。
正确答案
(1)Cu + H2O2+H2SO4=CuSO4+2H2O
(2)5.2≤x﹤5.4
(3)酒精灯、蒸发皿(烧杯)、玻璃棒
(4)乙
(5)①15a/b ×100%;②b
解析
略。
知识点
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1。由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1。回答下列问题。
(1)该配位化合物X的化学式为 。
(2)碳铂是一种含BA3分子的具有抗癌活性的金属配合物,碳铂的结构如图,其中碳原子的杂化方式有 。
(3)D元素原子的最外层电子轨道表式为 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(5) 元素B的单质可以和电石(CaC2)反应,生成氰氨化钙(CaCN2), 氰氨化钙和水反应可生成NH3。与CN22-互为等电子体的分子有 (填写一种化学式即可);写出CaCN2水解反应的化学方程式 。
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式 。单质E的晶胞如图所示,若设该晶胞的边长为acm,阿伏加德罗常数为NA,单质E的摩尔质量为Mg/mol,则表示该晶胞密度的计算式为ρ= g/cm3。
正确答案
(1)Cu(NH3)4SO4`H2O (1分)
(2)sp3杂化和sp2杂化
(3)
(4)H2O与H2O2之间形成氢键
(5)CO2或N2O ; CaCN2+3H2O=CaCO3+2NH3↑
(6)6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;
解析
略
知识点
27.某回收废料中含Al2O3、Fe2O3、Co2O3·CoO多种金属氧化物,某实验室科技人员欲将之分离并制备有关物质,设计流程如下图所示:
(1)过程②的离子方程式为 。
(2)过程④会产生有毒气体,反应的化学方程式为 。
(3)过程⑥用于制备绿色水处理剂,反应的离子方程式为 。
(4)过程⑦中碳酸钠溶液起的作用是 。
(5)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下表是粉红色的CoCl2·6H2O晶体受热分解时的情况:
认真分析以上数据,填写下列空白。③物质的化学式是____________。写出CoCl2·6H2O晶体受热分解生成②的化学反应方程式 。
正确答案
(1)AlO2-+2H2O +CO2 =Al(OH)3↓+HCO3-
(2)Co2O3·CoO+8HCl=3CoCl2+Cl2↑+ 4H2O
(3)2Fe(OH)3 +3ClO-+ 4OH-=2FeO42-+3Cl-+5H2O
(4)调整pH,提供碳酸根离子,使Co2+沉淀为CoCO3
(5)CoCl2·H2O CoCl2·6H2O
解析
略
知识点
氯化亚铜在工业上应用广泛。利用反应Cu2++Cu+2Cl-=2CuCl制氯化亚铜的流程如下图。氯化亚铜(CuC1)为白色晶体,不溶于硫酸、稀硝酸和醇,微溶于水,在空气中会被迅速氧化,能溶于浓盐酸,并生成配合物,该配合物加水稀释后会重新析出CuCl沉淀。
实验药品:铜丝20 g、氯化铵20 g、65% 硝酸10 mL、36%盐酸15 mL、水。
(1)反应①的化学方程式为 。
(2)析出的CuCl晶体要立即用无水乙醇洗涤,然后真空干燥、冷却,密封包装。真空干燥,密封包装的
目的是 。
(3)工业化生产时,乙醇可通过 方法回收并循环利用,而NH4Cl、 (填化学式)可直接循环利用。
(4)实验室用右上图装置制备CuCl。实验开始时,温度计显示反应液温度低于室温,主要原因是 ,电炉加热升温至50℃时停止加热,反应快速进行,烧瓶上方气体颜色逐渐由无色变为红棕色,从环保角度考虑,当 时才能停止通入氧气。
(5)氯化亚铜在工业上也可以利用酸性电镀废液(主要含Cu2+、Fe3+)制得高浓度硫酸铜溶液后,加入铁粉、氯化钠生成CuCl。反应的离子反应方程式为: 。
CuCl产率与混合液pH的关系如下图,析出CuCl晶体时的最佳pH在 左右。
正确答案
(1)NH4[CuCl2] =CuCl↓+NH4Cl
(2)加快乙醇和水的蒸发,防止CuCl被空气氧化。
(3)(3)蒸馏(1分),HNO3
(4)氯化铵溶于水吸收大量热量,造成反应液温度降低;烧瓶上方红棕色气体逐渐变为无色
(5)2Cu2++2Cl―+Fe=2CuCl2↓+ Fe2+ ;3
解析
略
知识点
解释下列事实的方程式正确的是
正确答案
解析
略。
知识点
著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面所作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是
正确答案
解析
略
知识点
下图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是
①C
②H2O2
③Na
④Fe
⑤HNO3
正确答案
解析
略。
知识点
扫码查看完整答案与解析