- 绿色化学
- 共179题
7.下列关于化工生产的叙述中,符合目前工业生产实际的是( )
正确答案
解析
A.石油工业中,利用馏分沸点不同,采用蒸馏的方法把石油分成不同沸点范围的产品,A错误;
B.硝酸工业中,不使用能被硝酸腐蚀的铁触媒作催化剂,B错误;
C.纯碱工业中,氨碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率,C正确;
D.改变压强,平衡常数不变,D错误。
故选C。
考查方向
解题思路
A.石油工业中,利用馏分沸点不同,采用蒸馏的方法把石油分成不同沸点范围的产品;
B.铁触媒作催化剂能被硝酸腐蚀;
C.纯碱工业中,氨碱法通过氨气和二氧化碳的循环利用,提高了原料的利用率;
D.改变压强,平衡常数不变。
易错点
解题的关键是注意硝酸工业中,不使用能被硝酸腐蚀的铁触媒作催化剂。
知识点
发展洁净煤技术、利用CO2制备清洁能源等都是实现减碳排放的重要途径。
21.将煤转化成水煤气的反应:C(s)+H2O(g) 
22.CO2制备甲醇:CO2(g)+3H2(g)
在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2(g) 和CH3OH(g) 浓度随时间变化如右图所示。
① 该反应化学平衡常数K的表达式是________。
② 0~9min时间内,该反应的平均反应速率ν(H2) =________。
③ 在相同条件下,密闭容器的体积缩小至0.5 L时,此反应达平衡时放出的热量(Q)可能是________(填字母序号)kJ。
a. 0 < Q < 29.5
b. 29.5 < Q < 36.75
c.36.75 < Q < 49
d. 49 < Q < 98
④ 在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如右图所示,L和X 分别表示温度或压强。
i. X表示的物理量是 。
ii. 判断L1与L2的大小关系,并简述理由: 。
23.利用铜基催化剂光照条件下由CO2和H2O制备CH3OH的装置示意图如下图所示,该装置工作时H+移向 极(填“a”或“b”),阴极的电极反应式是 。
正确答案
不变 加入催化剂后反应物和生成物的总能量不变
解析
加入催化剂后,不能改变反应物和生成物的总能量,所以△H不变,故答案为不变;加入催化剂后反应物和生成物的总能量不变。
考查方向
解题思路
加入催化剂后,不能改变反应物和生成物的总能量;
易错点
1、电极方程式书写。
2、外界条件对平衡的影响。
正确答案
① K =
② 0.25 mol•L-1•min-1
③ c
④ i.温度 ii.L1>L2 温度一定时,增大压强,CO2平衡转化率增大
解析
①CO2(g)+3H2(g)


②由图中可知,△c (CH3OH)=0.75mol/L,则△c (H2)=3△c (CH3OH)=0.75mol/L *3=2.25mol/L,则V(H2)=△c/t=2.25/9=0.25 mol·L-1·min-1,故答案为 0.25 mol·L-1·min-1;
③当体积为1L时,△n(CH3OH)=0.75mol,由 CO2(g)+3H2(g)
④ i、由图可知,随着X的增大,CO2的平衡转化率是减小的,由方程式CO2(g)+3H2(g)
考查方向
解题思路
①CO2(g)+3H2(g)
②由图中可知,△c (CH3OH)=0.75mol/L,则△c (H2)=3△c (CH3OH)=0.75mol/L *3=2.25mol/L,则V(H2)=△c/t=2.25/9=0.25 mol·L-1·min-1
③当体积为1L时,△n(CH3OH)=0.75mol,由 CO2(g)+3H2(g)
④ i、由图可知,随着X的增大,CO2的平衡转化率是减小的;
易错点
1、电极方程式书写。
2、外界条件对平衡的影响。
正确答案
①a
②CO2 + 6H+ + 6e- == CH3OH + H2O
解析
由图可知,装置为电解池,a为阴极,b为阳极,则H+应向阴极a的方向移动,阴极发生的反应为甲醇在酸性条件下得电子生成二氧化碳,电极反应式为CO2 + 6H+ + 6e- == CH3OH + H2O,故答案为① a ② CO2 + 6H+ + 6e- == CH3OH + H2O;
考查方向
解题思路
由图可知,装置为电解池,a为阴极,b为阳极
易错点
1、电极方程式书写。
2、外界条件对平衡的影响。
1.化学与人类生产、生活密切相关,下列说法正确的是
正确答案
解析
有机玻璃的主要成分是有机高分子化合物(聚甲基丙烯酸甲酯),而生活中最常见的玻璃的主要成分是SiO2、Na2SiO3等,A答案说的是有机玻璃,有机玻璃不是硅酸盐材料,所以A错;煤的气化是C(碳)与水蒸气反应的到气体燃料,煤的液化是煤与H2在催化剂条件下发生反应转化为液体燃料。煤的气化和液化都属于化学变化,所以B错;纯银器在空气中变黑是因为和空气中的氧气等发生化学反应,银与氧气反应属于化学腐蚀,不属于电化学腐蚀,所以C错;硫酸亚铁中的铁显+2价,Fe2+易被氧化成为Fe3+,而缺铁性贫血是由于人体中缺乏Fe2+,维生素C具有还原性,可以防止Fe2+易被氧化成为Fe3+,所以本题选D
考查方向
解题思路
区别概念,加深理解和记忆。1、有机玻璃的主要成分是有机高分子化合物(聚甲基丙烯酸甲酯),普通玻璃的主要成分是SiO2、Na2SiO3等。煤的气化是煤与水蒸气发生化学反应。化学腐蚀是物质直接发生化学反应,而电化学腐蚀会在金属表面形成微小的原电池。维生素C具有还原性,可防止物质被氧化。
易错点
此题比较简单,很多内容也是教材中原话,错误在于1、对于某些物质的成分没有理解,对于玻璃和有机玻璃混为一谈,概念上区分不清;2、物理变化与化学变化的概念理解不清楚,对于煤的气化和液化的概念及过程记忆不够深;3、对电化学腐蚀和化学腐蚀理解透彻,本题的C答案就可以排除掉。本题如果选错,错就错在有些概念上没有理解,将自己的想法强加于此题
知识点
2.下列物质反应后,固体质量减轻的是
正确答案
解析
3Fe+4H2O(g)=Fe3O4+4H2,Fe3O4的相对分子质量大于Fe的,所以是质量增大的反应,所以A错;2CO2+2Na2O2=2Na2CO3+O2,Na2CO3的相对分子质量是106,,Na2O2的相对分子质量是78,反应前的相对分子质量比较小,反应后的相随分子质量增大,所以B错;Zn+CuSO4=ZnSO4+Cu,CuSO4、ZnSO4使溶质存在于溶液中不是固体,所以由Zn(相对原子质量是65)变为Cu(相对原子质量是64)是质量减小的反应,所以C正确;D选项中反应前后都是固体,没有出现气体或是液体,根据质量守恒定律,其反应前后的质量不变
考查方向
解题思路
首先写出四个选项中的化学反应方程式,观察化学反应前后的物质的状态,此题主要说的是固体质量的变化,所以本题中出现的所有的气体和液体都可以排除点,然后观察化学反应前的固体的相对分子质量和反应后固体的相对分子质量,前后比较,反应物固体的相对分子质量大,反应后生成物的相对分子质量小,就是本体的答案了。
易错点
不会写化学反应方程式,对反应前后的物质变化分析不清楚,对元素守恒定律理解不清。
知识点
开发新能源是解决环境污染的重要举措,工业常用CH4与CO2反应制备H2和CO,再H2和CO利用合成甲醇。
26. 已知:① 2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H1=-1274.0KJ/mol
② 2CO(g)+O2(g)=2CO2(g) △H2=-566.0KJ/mol
③ H2O(g)=H2O(l) △H3=-44KJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 。
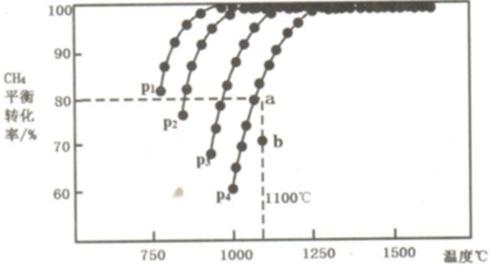
27.在恒容密闭容器中通入CH4与CO2,使其物质的量浓度为1.0mol/L,在一定条件下发生反应:CO2(g) + CH4(g) 
则:①该反应的△H 0(填“<、= 或>”);
②压强P1、P2、P3、P4由大到小的关系为 。压强为P4时,在b点:v(正) v(逆)。(填“<、= 或>”)
③对于气相反应,用某组分(B)的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数(记作Kp),则该反应的平衡常数的表达式Kp= ;如果P4=0.36MPa,求a点的平衡常数Kp= ;(保留3位有效数字,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
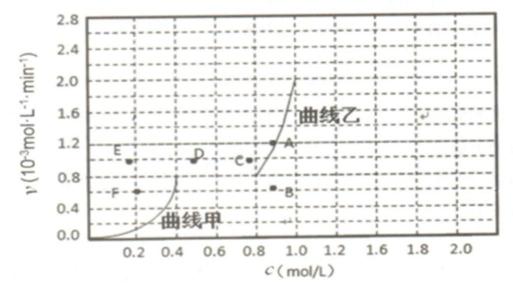
④为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制出了2条速率—浓度 关系曲线:v正~c(CH4)和v逆~c(CO)。
则:ⅰ)与曲线v正~c(CH4)相对应的是上图中曲线 (填“甲”或“乙”)。
ⅱ)当降低到某一温度时,反应重新达到平衡,相应的平衡点分别为 (填字母)。
正确答案
CH3OH(l)+ O2(g)=CO(g)+2H2O(l)△ H=-442 kJ▪mol-1
解析
根据盖斯定律可以求出该反应的热化学方程式为:CH3OH(l)+ O2(g)=CO(g)+2H2O(l)△ H=-442 kJ▪mol-1
考查方向
解题思路
根据盖斯定律可以求出该反应的热化学方程式为:CH3OH(l)+ O2(g)=CO(g)+2H2O(l)△ H=-442 kJ▪mol-1
易错点
读图分析反应平衡移动的方向。
正确答案
① >; ② p4> p3> p2 >p1 ;>
③ P2(CO)·P2(H2)/(P(CO2) ·P(CH4)) ;1.64(MPa)2
④ i)乙 ; ii)B F
解析
①由图可知,温度升高甲烷的平衡转
②由该反应式可知,增大压强有助于反应向逆反应方向进行,所以从P1到P4压强依次增大,由图可知此时该反应还在向正反应方向进行着,所以正反应速率大于逆反应速率。
③以气体压强表示气体的浓度则平衡常数为:P2(CO)·P2(H2)/(P(CO2) ·P(CH4))
④由图可知,浓度增大一点,乙曲线对应的反应速率增大的非常迅速,所以乙曲线对应甲烷的反应速率曲线。
考查方向
解题思路
①由图可知,温度升高甲烷的平衡转
②由该反应式可知,增大压强有助于反应向逆反应方向进行。
④由图可知,浓度增大一点,乙曲线对应的反应速率增大的非常迅速。
易错点
读图分析反应平衡移动的方向。
目前“低碳减排”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。
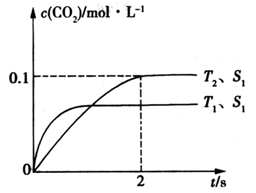
23.汽车尾气净化的主要原理为2NO(g)+2CO(g)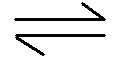
①该反应的△H_____________0(填“>”或“<”)。
②在T2温度下,0-2s内的平均反应速率v(N2) =____________mol/(L·s)。
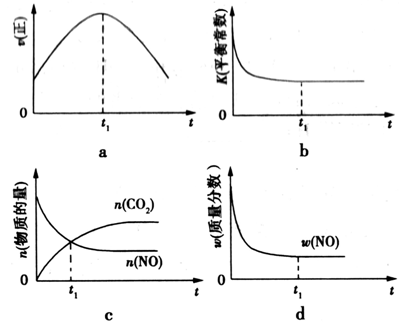
③若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_______________(填代号)。
24.直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1
2NO2(g)=N2O4(g) △H=-56.9kJ·mol-1
写出CH4(g)催化还原N2O4(g)的热化学方程式:
___________________________________。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。如图是通过人工光合作用,以CO2(g)和H2O(g)为原料制备HCOOH和O2的原理示意图。催化剂b表面发生的电极反应为_________________。
③常温下0. 1 mol·L-1的HCOONa溶液pH为10,则HCOOH的电离常数Ka=______________mol·L-1(填写最终计算结果)。
正确答案
①<
②0.025
③bd
解析
③a.反应达到平衡状态时,各物质的反应速率不再变化,故错误。
b.该反应在绝热、恒容的密闭体系中进行,相当于升高温度,当温度不变时,化学平衡常数不变,故正确。
c.二氧化碳和一氧化氮的物质的量相等时,该反应不一定达到平衡状态,故错误。
d.反应达到平衡状态时,各物质的质量分数不再发生变化,故正确。
考查方向
解题思路
(1)T1>T2,先拐先平温度高,温度越高,二氧化碳浓度越低,所以该反应是△H<0。具图分析先拐先平,定一议二。
(2)②+①得到CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1 kJ·mol-1,据此计算反应的焓变;电解反应中阴极上发生得电子的还原反应,根据反应原理来回答书写;
(3)电离常数K=
正确答案
①CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1 kJ·mol-1
②CO2+2H++2e-=HCOOH ③10-7
解析
①将第一个方程式减第二个方程式得:
CH4(g)+N2O4(g)
②催化剂b表面上二氧化碳得电子和氢离子反应生成甲酸,所以发生的电极反应式为:
CO2+2H++2e-
考查方向
解题思路
(1)T1>T2,先拐先平温度高,温度越高,二氧化碳浓度越低,所以该反应是△H<0。具图分析先拐先平,定一议二。
(2)②+①得到CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) △H=-810.1 kJ·mol-1,据此计算反应的焓变;电解反应中阴极上发生得电子的还原反应,根据反应原理来回答书写;
(3)电离常数K=
6.2013年4月24日,东航首次成功进行了由地沟油生产的生物航空燃油的验证飞行.能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等)的方法是
正确答案
解析
A.地沟油、矿物油均能燃烧,不能区别,故A错误;
B.地沟油、矿物油均为混合物,没有固定沸点,不能区别,故B错误;
C.地沟油、矿物油均不溶于水,且密度均比水小,不能区别,故C错误;
D.加入足量氢氧化钠溶液共热,不分层的是地沟油,分层的为矿物油,现象不同,能区别,故D正确;
故选D.
考查方向
解题思路
A、地沟油属于油脂,含有C、H、O三种元素,矿物油中含有C、H元素,均可燃烧,错误;
B、矿物油为混合物,没有恒定的溶沸点,错误;
C、地沟油与矿物油的密度均小于水,都会浮在水面上,错误;
D、地沟油的主要成分为油脂,与NaOH可发生水解,矿物油不能与其反应,会浮在液面上方,正确;所以答案为D。
易错点
1、地沟油属于油脂,矿物油属于烃。
2、油脂与NaOH可发生水解,矿物油属于烃不能发生水解。
知识点
7.化学是材料科学发展的基础。下列说法正确的是
正确答案
解析
A.氧化铝纳米材料属于属于纯净物,胶体属于混合物,A错误;
B.聚乙炔是高分子材料,聚合物经溴或碘掺杂之后,导电性会提高到金属水平,可导电,B正确;
C.钢化玻璃、防弹玻璃均属于硅酸盐材料,有机玻璃是聚甲基丙烯酸甲脂,是有机物,C错误;
D.刚玉的成分是氧化铝而不是MgO,氧化铝熔点很高,可以作耐火材料,D错误。
故选B。
考查方向
解题思路
A.氧化铝纳米材料属于属于纯净物,胶体属于混合物;
B.聚乙炔是高分子材料,聚合物经溴或碘掺杂之后,导电性会提高到金属水平,可导电;
C.钢化玻璃、防弹玻璃均属于硅酸盐材料,有机玻璃是聚甲基丙烯酸甲脂,是有机物;
D.刚玉的成分是氧化铝而不是MgO,氧化铝熔点很高,可以作耐火材料。
易错点
本题考查了硅及其化合物的用途,明确物质的成分及其性质是解本题关键,了解常见元素化合物性质,性质决定用途,题目难度不大。
知识点
7.化学与材料、生活和环境密切相关。下列有关说法中错误的是()
正确答案
解析
铁粉是抗氧化剂,A项错误;脱硝技术能减少污染,B项正确;明矾水解产生氢氧化铝胶体,可以净水,但不能杀菌消毒,C项正确;碳化硅、陶瓷和碳纤维都是一种新型无机非金属材料,D正确。
考查方向
解题思路
理清生活中常见添加剂和常见物质的化学本质。
易错点
误认为铁粉可以做干燥剂,明矾可以杀菌消毒。
知识点
7.化学与生产、生活密切相关。下列说法不正确的是
正确答案
解析
生石灰只能作为干燥剂,不能作为脱氧剂,C选项错误。
考查方向
解题思路
只要理解干燥剂与脱氧剂的区别,即可轻松解决本题。
易错点
混淆脱氧剂与干燥剂的概念。
知识点
扫码查看完整答案与解析