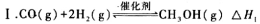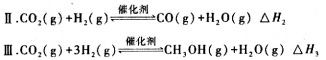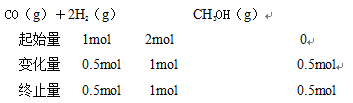- 有机化合物的异构现象
- 共52题
11.下列实验方案中,能达到相应实验目的的是( )
正确答案
解析
A.实验室利用乙醇的消去反应制取乙烯时,要有温度计测定混合液的温度,所以温度计的位置要在液面下,所以A错误;
B.石蜡油在催化剂作用下分解得到的产物是烷烃、烯烃混合物,还会生成芳香烃,所以使酸性高锰酸钾褪色不一定就得到了乙烯,B错误;
C.乙烯、乙炔均可以使酸性高锰酸钾褪色,因此不能验证出混合气体中一定有乙烯,C错误;
D.由于金属钠在水中的反应比乙醇中的反应剧烈,所以就可以判断出水中的羟基氢原子比乙醇分子中羟基的氢原子的活泼性强,所以D 正确。
考查方向
通过考查实验室乙烯的制备、石蜡的分解反应、气体混合物成分的检验以及化学实验方案设计与评价,进一步考查化合物的性质以及化学实验基本操作。
解题思路
要注意仔细观察实验装置图中的相关信息,然后结合物质的性质和实验知识分析解答。
A.实验室利用乙醇的消去反应制取乙烯时,要有温度计测定混合液的温度,所以温度计的位置要在液面下;
B.石蜡油在催化剂作用下分解得到的产物是烷烃、烯烃混合物,还会生成芳香烃;
C.乙烯、乙炔均可以使酸性高锰酸钾褪色,
D.由于金属钠在水中的反应比乙醇中的反应剧烈,所以就可以判断出水中的羟基氢原子比乙醇分子中羟基的氢原子的活泼性强。
易错点
不了解实验室乙烯的制备中温度计的作用;不了解石蜡油分解得到的产物是烷烃,烯烃混合物,还会生成芳香烃;乙烯、乙炔均可以使酸性高锰酸钾褪色。
知识点
granny
正确答案
hard
正确答案
28.药物M主要用于防治骨质疏松症和乳腺癌,其结构式为
旧路线
新路线
已知:
①半缩醛可水解:
②卤代烃(RX)与镁于室温下在干燥乙醚中反应,生成格氏试剂(RMgX):
RX+Mg
格氏试剂很活泼,能与许多物质发生反应。如:
完成下列填空:
(1)写出反应类型。
①____________ ②____________
(2)写出结构简式。
A____________ D____________
(3)旧法中的原料
(4)写出B→C反应的化学方程式。
(5)设计一条以

(合成路线常用的表示方法为:A反应试剂反应条件B……反应试剂反应条件目标产物)
正确答案
(1)取代反应;消除反应
(2) 
(3) 6;
(4)
(5)
解析
解析已在路上飞奔,马上就到!
知识点
8.联苯(两个苯环单键相连)的二氯代物有( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.化学
正确答案
知识点
7.2015年10月,中国女药学家屠呦呦因创制新型抗疟药——青蒿素和双氢青蒿素的贡献获得诺贝尔生理学或医学奖。青蒿素和双氢青蒿素的结构式如下图。从青蒿中提取青蒿素主要采用有机溶剂提取的方法。下列有关说法不正确的是
正确答案
解析
A.青蒿素属于有机化合物,含有酯基,易溶于有机溶剂,主要采用萃取的方法提取青蒿素,正确;
B.从青蒿素的结构式可以看出,青蒿素的分子式为C15H22O5,正确;
C.青蒿素加氢,羰基变为醇羟基,还原可制得双氢青蒿素,正确;
D.芳香族化合物含有苯环,青蒿素和双氢青蒿素都不含有苯环,都不是芳香族化合物,错误。
故选D。
考查方向
解题思路
A.青蒿素属于有机化合物,含有酯基,易溶于有机溶剂;
B.从青蒿素的结构式可以看出,青蒿素的分子式为C15H22O5;
C.青蒿素加氢,羰基变为醇羟基;
D.芳香族化合物含有苯环。
易错点
本题难度一般,解题的关键是青蒿素的分子式,注意原子个数。
知识点
甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景。
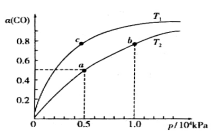
15.已知反应CO(g)+2H2(g)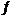
则x=______。
16.在一容积可变的密闭容器中,l mol CO与2 mol 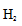
CO(g)+2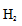
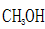
①a、b两点的反应速率:v(a)____ v(b)(填“>”、“<”或“=”)。
②T1____T2(填“>”、“<”或“=”),原因是___________________________。
③在c点条件下,下列叙述能说明上述反应达到化学平衡状态的是______(填代号)。
a.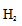
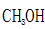
b.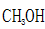
c.混合气体的密度不再改变
d.CO和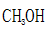
④计算图中a点的平衡常数Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
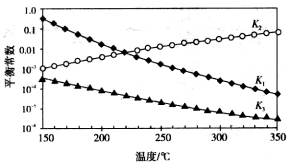
17.利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如下图所示。
则△H1_____△H3,(填“>”、“<”或“=”),理由是___________________。
正确答案
1076
解析
根据反应物的键能的总能量减去生成物的键能的总能量等于焓变值,正确写出反应物和生成物的各物质的结构式,可以列式计算,CO中是一个碳氧三键,1molH2中含有1mol的H-H键,2molH2中含有2mol的H-H键,对于1molCH3OH中有3mol的C-H键,和1mol C-O键和1mol O-H键,列式为x+2×436-(3×413+343+465) =-99,解出x=1076;
考查方向
盖斯定律的应用,对可逆反应中平衡移动的影响因素的考查,根据焓变的大小来判断温度、浓度等对化学平衡移动的影响的考查,同时,也对考生的数形结合题型的综合咔嚓
解题思路
对化学反应中的各种物质的结构式必须会写,对其中所含的各种键能的个数必须要清楚,用反应物的总的键能减去生成物的总的键能等于焓变值,可以计算出x的值;CO(g)+2H2(g) CH3OH(g) △H <0,增大压强,化学反应速率加快,平衡向气体体积减小的方向移动,即向正反应方向移动,CO的转化率就会增大,在结合图形就可以判断;此反应是一个放热反应,升高温度,平衡向着吸热的反应方向移动,根据这一点就可找出T1与T2之间的关系;对于可逆反应,其平衡标志是正反应速率的与你反应速率或是平衡后体系中的各组分的浓度、物质的量等不再发生改变;对于此题中的化学平衡常数需要根据阿伏加德罗定律PV=nRT,压强之比等于物质的量之比即可计算,大需要注意后面括号内的提示,注意审题;平衡常数只受温度的影响,在根据盖斯定律综合判断即可做出确定最后的答案。
易错点
反应物总能量和生成物总能量做差是会颠倒,导致计算结果出现负值,浓度、催化剂、压强、温度对化学平衡移动的影响及如何影响抓不住重点,不会结合所给的图形找到关键点来和化学反应方程式结合做出正确的判断,本题还需要阿伏加德罗定律来计算出化学平衡表达式,如果对阿伏加德罗定律应用很陌生,本题中的化学平衡表达式的计算会出现错误。
正确答案
① <
② < ,CO(g)+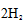
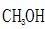
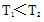
③bc
④ 1.6×10—7(KPa)--2
解析
① 从图中可以看出b点的转化率高于a点的,对于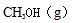
② 图中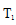
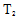
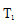
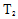

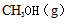
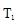
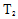
③可逆反应达到平衡的标志是正反应速率等于逆反应速率或者是平衡后个反应物的组分不再发生改变,所以选b和c
④a点的平衡常数的计算首先列出三段式,再根据用平衡分压代替平衡浓度,分压=总压×物质的量分数来计算
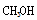
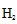
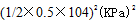
考查方向
盖斯定律的应用,对可逆反应中平衡移动的影响因素的考查,根据焓变的大小来判断温度、浓度等对化学平衡移动的影响的考查,同时,也对考生的数形结合题型的综合咔嚓
解题思路
对化学反应中的各种物质的结构式必须会写,对其中所含的各种键能的个数必须要清楚,用反应物的总的键能减去生成物的总的键能等于焓变值,可以计算出x的值;CO(g)+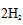
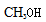
易错点
反应物总能量和生成物总能量做差是会颠倒,导致计算结果出现负值,浓度、催化剂、压强、温度对化学平衡移动的影响及如何影响抓不住重点,不会结合所给的图形找到关键点来和化学反应方程式结合做出正确的判断,本题还需要阿伏加德罗定律来计算出化学平衡表达式,如果对阿伏加德罗定律应用很陌生,本题中的化学平衡表达式的计算会出现错误。
正确答案
< 由图可知,随着温度的升高,K2增大,则△H 2>0,根据盖斯定律又得△H 3=△H 1+△H 2,所以△H 1<△H 3
解析
由图可知,随着温度的升高,K2增大,则△H 2>0,根据盖斯定律又得△H 3=△H 1+△H 2,所以△H 1<△H 3。
考查方向
盖斯定律的应用,对可逆反应中平衡移动的影响因素的考查,根据焓变的大小来判断温度、浓度等对化学平衡移动的影响的考查,同时,也对考生的数形结合题型的综合咔嚓
解题思路
对化学反应中的各种物质的结构式必须会写,对其中所含的各种键能的个数必须要清楚,用反应物的总的键能减去生成物的总的键能等于焓变值,可以计算出x的值;CO(g)+2H2(g) CH3OH(g) △H <0,增大压强,化学反应速率加快,平衡向气体体积减小的方向移动,即向正反应方向移动,CO的转化率就会增大,在结合图形就可以判断;此反应是一个放热反应,升高温度,平衡向着吸热的反应方向移动,根据这一点就可找出T1与T2之间的关系;对于可逆反应,其平衡标志是正反应速率的与你反应速率或是平衡后体系中的各组分的浓度、物质的量等不再发生改变;对于此题中的化学平衡常数需要根据阿伏加德罗定律PV=nRT,压强之比等于物质的量之比即可计算,大需要注意后面括号内的提示,注意审题;平衡常数只受温度的影响,在根据盖斯定律综合判断即可做出确定最后的答案。
易错点
反应物总能量和生成物总能量做差是会颠倒,导致计算结果出现负值,浓度、催化剂、压强、温度对化学平衡移动的影响及如何影响抓不住重点,不会结合所给的图形找到关键点来和化学反应方程式结合做出正确的判断,本题还需要阿伏加德罗定律来计算出化学平衡表达式,如果对阿伏加德罗定律应用很陌生,本题中的化学平衡表达式的计算会出现错误。
4.下列说法正确的是 ()
正确答案
解析
A项,该有机物的正确命名为2,2,4,5-四甲基-3,3-二乙基己烷,错误
B项,烯烃和醛类都能使酸性高锰酸钾褪色,无法鉴别,错误
C项,甘氨酸[NH2-CH(CH3)-COOH]和丙氨酸[NH2-CH(CH3)-COOH]缩合最多可形成4种二肽分别是NH2-CH(CH3)-COOH + NH2-CH(CH3)-COOH = NH2-CH(CH3)-CO-NH-CH(CH3)-COOH
NH2-CH2-COOH + NH2-CH2-COOH = NH2-CH2-CO-NH-CH2-COOH
NH2-CH(CH3)-COOH + NH2-CH2-COOH = NH2-CH(CH3)-CO-NH-CH2-COOH
NH2-CH2-COOH + NH2-CH(CH3)-COOH = NH2-CH2-CO-NH-CH(CH3)-COOH ,错误
D项,结构相似的分子,其相对分子质量越大熔沸点越高;羟基数目越多,氢键也越多,氢键越多沸点越高,也就是说羟基越多沸点越高,正确,本题正确答案是D
考查方向
解题思路
A项,该有机物的正确命名为2,2,4,5-四甲基-3,3-二乙基己烷,错误
B项,烯烃和醛类都能使酸性高锰酸钾褪色,无法鉴别,错误C项,甘氨酸[NH2-CH(CH3)-COOH]和丙氨酸[NH2-CH(CH3)-COOH]缩合最多可形成4种二肽分别是NH2-CH(CH3)-COOH + NH2-CH(CH3)-COOH = NH2-CH(CH3)-CO-NH-CH(CH3)-COOH NH2-CH2-COOH + NH2-CH2-COOH = NH2-CH2-CO-NH-CH2-COOH NH2-CH(CH3)-COOH + NH2-CH2-COOH = NH2-CH(CH3)-CO-NH-CH2-COOH NH2-CH2-COOH + NH2-CH(CH3)-COOH = NH2-CH2-CO-NH-CH(CH3)-COOHD项,结构相似的分子,其相对分子质量越大熔沸点越高;羟基数目越多,氢键也越多,氢键越多沸点越高,也就是说羟基越多沸点越高,正确A选项不正确,B选项不正确,C选项不正确,所有选D选项。
易错点
1、系统命名的方法,官能团的性质
2、有机物质的鉴别
知识点
11.分子式为C7H8的某有机物,它能使酸性高锰酸钾溶液褪色,但不能与溴水反应。在一定条件下与H2完全加成,加成后其一氯代物的同分异构体有( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析