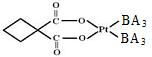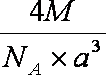- 原子核外电子排布
- 共93题
碳、氮、氧、氟都是位于第二周期的重要的非金属元素。请回答下列问题:
(1)基态氟原子的核外电子排布式是______________ 。
(2)C、N、O、F四种元素第一电离能从大到小的顺序是_________________。
(3)碳和另外三种元素均可形成化合物。四氟化碳的空间构型为____________,CF4可以利用甲烷与Cl2和HF在一定条件下反应来制备,其反应方程式为___________;CO是__________分子(填“极性”或“非极性”),CO的常见等电子体为N2、CN-,已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为___________;C3N4是一种新型材料,它的硬度比金刚石还高,可做切割工具,可推测出C3N4属于_________晶体。
(4)N4分子结构和白磷一样都是正四面体。又已知断裂1molN-N键吸收167kJ热量,生成1 molN≡N键放出942kJ热量,0.1 molN4转变为N2将放出____________热量:
(5)CaF2和CaC2都属于离子晶体。CaF2晶体的密度为a g·cm-3,则晶胞(如图)的体积是_______________(只要求列出算式)。
(6)CaC2晶体的晶胞与氯化钠相似,但由于CaC2晶体中的




正确答案
答案:
(1)1s22s22p5 (1分)
(2)F>N>O>C (2分)
(3)正四面体(1分) CH4 + 4 Cl2 + 4 HF 
极性(1分) 1:1(或2:2)(1分) 原子(1分)
(4)88.2 kJ(2分)
(5)
(6)4 (1分) 
解析
略
知识点
A、B、C、D是前姆周期原予序数依次增大的四种元素,其中A和B原子的价电子层中朱成对电子均只有1个,并且A-和B+的电子数褶差为8;C和D与B位于同一周期,C和D的价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1)四种元素中第一奄离能最小的是____,电负性最大的是____(填元素符号),C的价电子排布式为____。
(2)A的气态氢化物的熔沸点比下周期阍主族元素气态氢化物高,原因是____。
(3)
(4)D的单质粉末在CO气流中轻微加热,生成无色挥发性液态D(CO)4,基四面体构型。423 K时,D(CO)4分解为D和CO,从而制得高纯度的D粉末。D(CO)4的最体类型是____;推测D(CO)t易溶于下列____溶剂中(填序号)。
a . 乱水 b.四氯化碳 c.苯 d.硫酸镍溶液
(5)据报道,只含碳、镁和D三种元素的晶体具有超导性。该晶体的晶胞结构如下图所示,试写出该晶体的化学式____。晶体中每个镁原子周围距离最近的D原子有____个。
正确答案
解析
(1)K(1分),F(1分), 3d64s2(1分)
(2)HF分子之间可以形成氢键(2分)
(3)离子键、配位键(2分);[FeF6]3-(2分)
(4)分子晶体 (1分) bc(1分)
(5)MgCNi3 (2分) 12(2分)
知识点
下列有关化学用语表达正确的是
正确答案
解析
略
知识点
前四周期的五种元素A、B、C、D、E原子序数逐渐变大,其中C、D元素同主族且原子序数D为C的二倍,B的第一电离能大于C,E原子的外围电子排布为(n-l)d (n+6)ns1。由它们组成的配位化合物X为深蓝色的结晶水合物,其原子个数比为14:4:5:1:1。回答下列问题。
(1)该配位化合物X的化学式为 。
(2)碳铂是一种含BA3分子的具有抗癌活性的金属配合物,碳铂的结构如图,其中碳原子的杂化方式有 。
(3)D元素原子的最外层电子轨道表式为 。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 。
(5) 元素B的单质可以和电石(CaC2)反应,生成氰氨化钙(CaCN2), 氰氨化钙和水反应可生成NH3。与CN22-互为等电子体的分子有 (填写一种化学式即可);写出CaCN2水解反应的化学方程式 。
(6)A元素与E元素可形成一种红色离子化合物Y,其原子个数比为1:1,该化合物Y可与稀硝酸反应,生成一种蓝色溶液和两种无色气体(其中一种为A元素的单质),写出该反应的化学方程式 。单质E的晶胞如图所示,若设该晶胞的边长为acm,阿伏加德罗常数为NA,单质E的摩尔质量为Mg/mol,则表示该晶胞密度的计算式为ρ= g/cm3。
正确答案
(1)Cu(NH3)4SO4`H2O (1分)
(2)sp3杂化和sp2杂化
(3)
(4)H2O与H2O2之间形成氢键
(5)CO2或N2O ; CaCN2+3H2O=CaCO3+2NH3↑
(6)6CuH+16HNO3=6Cu(NO3)2+3H2↑+4NO↑+8H2O;
解析
略
知识点
16O和18O是氧元素的两种原子,NA表示阿伏伽德罗常数,下列说法正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析