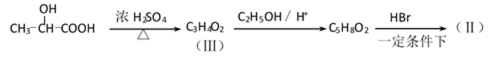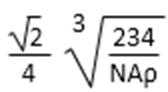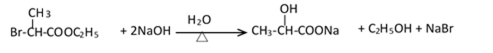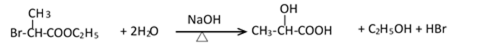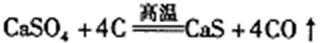- 原子核外电子排布
- 共93题
请考生从给出的3道化学题中任选一题做答。
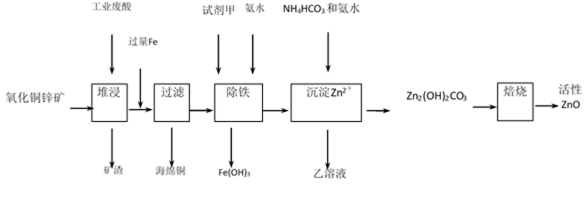
36.某工厂利用工业废酸(10%H2SO4)堆浸某废弃的氧化铜锌矿制取活性ZnO, 方案如下:
已知:298K时各离子开始沉淀及完全沉淀时的pH:
(1) 氧化铜锌矿中含有少量CuS和ZnS,在稀H2SO4作用下ZnS可溶而CuS不溶,这是由于同温下Ksp (ZnS) _________Ksp (CuS)(">" “<”,或“=”)。
(2) 在除铁过程中选用下列试剂中的_________作为试剂甲最合适:
A. Cl2
B. HNO3
C. KMnO4
D. H2O2
(3) 除铁过程中加入氨水的目的 ___________ ,实验中PH应控制的范围 ___________ ;
(4) 加试剂甲后,Fe3+,与氨水生成Fe(OH)3的离子方程式 ___________ ;
(5) 298K时,检验乙溶液中是否残留较多Fe3+的方法 ___________ ;
(6)乙的溶液可直接用作氮肥,乙的化学式 ___________;
(7) Zn2(OH)2CO3焙烧的化学方程式 ___________。
37.已知:A、B、C、D、E、F六种元素,原子序数依次增大。A原子核外有两种形状的电子云,两种形状的电子云轨道上电子云相等;B是短周期中原子半径最大的元素;C元素3p能级半充满;E是所在周期电负性最大的元素;F是第四周期未成对电子最多的元素。试回答下列有关的问题:
(1)写出F元素的电子排布式_______。
(2)己知A元素扣一种氢化物分子中含四个原子,则在该化合物的分子中A原子的杂化轨道类型为______。
(3)己知C、E两种元素形成的化合物通常有CE3、CE5两种。这两种化合物中一种为非极性分子,一种为极性分子,属于极性分子的化合物的分子空间构型是______。
(4)B、C、D、E的第一电离能由大到小的顺序是______ (写元素符号)。
四种元素最高价氧化物的水化物形成的溶液,物质的量浓度相同时,pH由大到小的顺序是______(写化学式)。
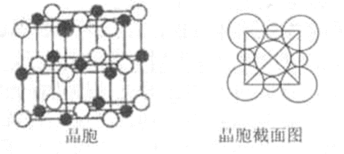
(5)由B、E两元素形成的化合物组成的晶体中,阴、阳离子都有球型对称结构, 它们都可以看作刚性圆球,并彼此“相切”。如下图所示为B、E形成化合物的晶胞结构图以及晶胞的剖面图:
晶胞中距离一个Na+最近的Na+有____________个。
若晶体密度为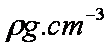
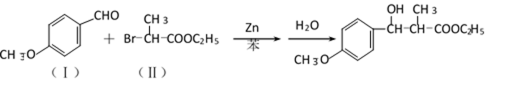
38.有机合成中增长碳链是一个重要环节。如下列反应:
用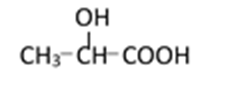
(1)(Ⅰ)的分子式为___________;(Ⅲ)的结构简式为___________ 。
(2)(Ⅱ)与足量的热NaOH溶液反应的化学方程式为___________ 。
(3)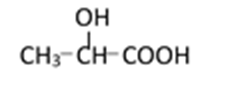
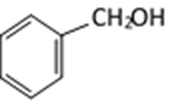
(4)(Ⅰ)的一种同分异构体能发生银镜反应,还能水解生成不含甲基的芳香化合物(Ⅳ)。(Ⅳ)的结构简式为 ___________。
正确答案
见解析。
解析
36.(1)>
(2) D
(3)调节溶液的pH,使Fe3+沉淀完全, 3.2~6.2
(4)Fe3++3NH3·H2O === Fe(OH)3↓+3 NH4+
(5)取少量乙溶液于试管中,滴入几滴KSCN溶液,若出现红色,说明还有较多Fe3+,若无红色出现,说明Fe3+沉淀完全 ,
(6)(NH4)2SO4
(7)Zn2(OH)2CO3 == 2ZnO+CO2↑ + H2O
37.(1)[Ar]3ds1
(2)sp3
(3)三角锥形
(4)Cl> P> S>Na,NaOH > H3PO4 >HClO4>H2SO4
(5)12;
38.(1)C8H8O2 ;CH2=CH-COOH
(2)
或
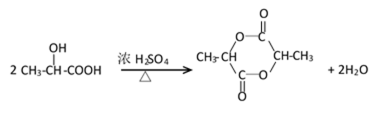
(3) 
取代反应(或酯化反应)
(4) 
知识点
符号“3px”没有给出的信息是()
正确答案
解析
略
知识点
其中第29、30题为物理题,第31、32题为化学题,考生从两道物理题、两道化学题中各任选一题作答。
31.[化学----物质结构与性质]
(1)铬的外围电子排布式是( ) ,与铬同周期,最外层有3个未成对电子数的元素名称是( ),该元素对应的最低价氢化物分子的中心原子采取了( )杂化方式,分子的空间构型是( ) 。
(2)富勒烯
(3)氟化氢水溶液中存在氢键有( )种。
(4)2011年诺贝尔化学奖授予了因发现准晶体材料的以色列科学家。某准晶体是锰与另一个短周期元素X形成的凝固态。已知:金属的电负性一般小于1.8。元素X与同周期相邻元素Y、Z的性质如下表:则X元素符号是( ),锰与X在准晶体中的结合力为 ( )。
32.[化学—有机化学基础]
莽草酸(C7H10O5)可有效对付致命的H5N1型禽流感病毒的药物“达菲”的重要成分,它可从中药八角茴香中提取得到。右图是以莽草酸为原料合成某些物质的路线:
根据上图回答下列问题:
(1)A中含有的两种含氧官能团分别是_____________________
(2)已知烯醇式结构(C=C-OH)不能稳定存在、则莽草酸的结构简式为( ) 。
(3)莽草酸→C的反应类型是( ) 。
(4)写出C→D的化学反应方程式( )。
(5)与C具有相同官能团的同分异构体(含C)共有( )种。
31.[化学----物质结构与性质]
(1)铬的外围电子排布式是 ,与铬同周期,最外层有3个未成对电子数的元素名称是 ,该元素对应的最低价氢化物分子的中心原子采取

(2)富勒烯(


(3)氟化氢水溶液中存在氢键有 种。
(4)2011年诺贝尔化学奖授予了因发现准晶体材料的以色列科学家。某准晶体是锰与另一个短周期元素X形成的凝固态。已知:金属的电负性一般小于1.8。元素X与同周期相邻元素Y、Z的性质如下表:则X元素符号是 ,锰与X在准晶体中的结合力为 。
32.[化学—有机化学基础]
莽草酸(C7H10O5)可有效对付致命的H5N1型禽流感病毒的药物“达菲”的重要成分,它可从中药八角茴香中提取得到。右图是以莽草酸为原料合成某些物质的路线:
根据上图回答下列问题:
(1)A中含有的两种含氧官能团分别是_____________________
(2)已知烯醇式结构(C=C-OH)不能稳定存在、则莽草酸的结构简式为 。
(3)莽草酸→C的反应类型是 。
(4)写出C→D的化学反应方程式 。
(5)与C具有相同官能团的同分异构体(含C)共有 种。
正确答案
正确答案
请考生从给出的3道化学题中任选一题做答。
36.水处理技术在生产、生活中应用广泛。
(1)含有较多________离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为________________________(写出一个即可)
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应先使硬水通过_______(填“RH”或“ROH”)型离子交换树脂,原因是_______________________。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为________。电渗析法净化水时,使离子通过半透膜的推动力是________。
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的________。水处理技术在生产、生活中应用广泛。
37.下面是C60、金刚石和二氧化碳的分子模型。
请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:_________________
(2)从晶体类型来看,C60属于_________晶体。
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目是__________________________;晶体硅中硅原子与共价键的个数比为
(4)图丙是二氧化碳的晶胞模型,图中显示出的二氧化碳分子数为14个。实际上一个二氧化碳晶胞中含有________个二氧化碳分子,二氧化碳分子中

(5)有机化合物中碳原子的成键方式有多种,这也是有机化合物种类繁多的原因之一。丙烷分子中2号碳原子的杂化方式是_______,丙烯分子中2号碳原子的杂化方式是_______,丙烯分子中最多有 个原子共平面。
38.一种分子式为C11H12O2的芳香酯(H)是一种香精的调香剂,可由下列路线合成:
回答下列问题:
(1)A中含有的官能团是( )(写名称)。G的结构简式是( ) 。反应⑤的反应类型是( ) 。
(2)X是F的同分异构体,X分子中含有一个苯环,且核磁共振氢谱有3个峰,则X可能的结构简式是( ) 。
(3)写出有关化学方程式:
②( );
③( );
⑧ ( ) 。
(4)E与甲醇发生酯化反应后,通过加聚反应能生成一种高分子化合物(俗称有机玻璃),写出此有机玻璃的结构简式是 ( ) 。
正确答案
(2)RH;先通过阴离子交换树脂可能产生Mg(OH)2等沉淀而影响树脂交换效果
(3)反渗透法;电势差(或电场力)
(4)电导率(或电阻率)
37.(1)
(2)分子
(3)6; 1:2
(4)4; 1:1
(5)sp3; sp2; 7
38.(1)碳碳双键;
解析
解析已在路上飞奔,马上就到!
知识点
36.请从36~38题中任选一题作答
36.【化学——选修2:化学与技术】
近年来,为提高能源利用率,西方提出共生系统。特指为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的( )极(填“正”或“负”),负极反应式为( )。用这种方法处理SO2废气的优点是____
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
①生产中,向反应II的溶液中加入适量还原性很强的对苯二酚等物质,其目的是( )。
②下列有关说法正确的是( )。
A.反应I中需鼓人足量空气,以保证二氧化硫充分氧化生成硫酸钙。
B.反应Ⅲ中发生反应的化学方程式为
C.反应,IV需控制温度在60~70℃,目的之一是减少碳酸氢铵的分解。
D.反应V中的副产物氯化铵可用作氮肥。
③反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是( )。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式:( )。
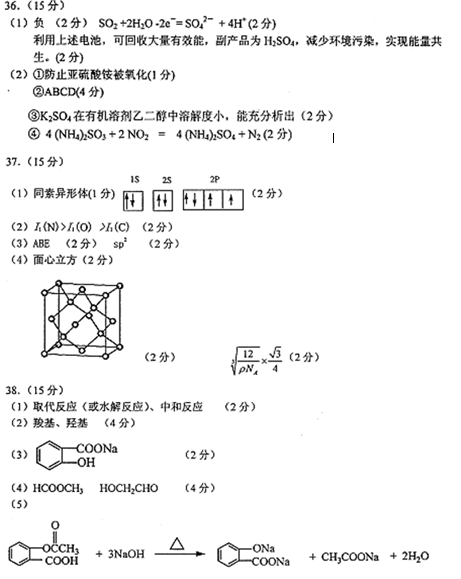
37.【化学——选修3:物质结构与性质】
下图分别是金刚石、石墨、足球烯和碳纳米管的结构示意图。图中小黑点或小黑圈均代表碳原子。
(1)四种物质互称为 ( )。写出碳原子的基态电子排布图 ( )。
(2)试比较:第一电离能I1(C)、I1(N)、I1(O)由大到小的顺序为( ) 。
(3)石墨中存在的作用力有( )。A:σ键 B:π键 C:氢键 D:配位键 E:分子间作用力石墨中碳原子采取的杂化方式是 ( )。
(4)仔细观察图A金刚石结构,有人从中找出它的晶胞结构是碳原子位于立方体的所有顶点及面心处,将立方体切割成8个小立方体,在其中4个互不相邻的立方体体心各有一个碳原子。请写出金刚石属于晶胞,在方框中画出一个晶胞结构示意图:
若金刚石的密度为ρg·cm-3,试计算碳原子的半径为( )cm。
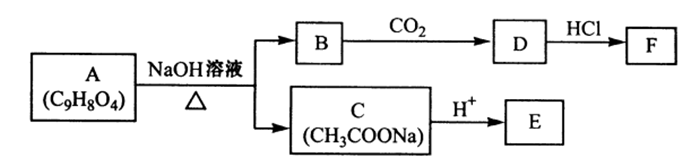
38.【化学——选修5:有机化学基础】
A为药用有机物,从A出发可发生下图所示的一系列反应。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基连在相邻的碳原子上;D不能跟NaHCO3溶液反应,但能跟NaOH溶液反应。
请回答:
(1)A转化为B、C时,涉及到的反应类型有( ) 、( ) 。
(2)F中所含官能团的名称是 ( )、( );
(3)D的结构简式为 ( )。
(4)E的两种同分异构体Q、R都能在一定条件下发生银镜反应,在核磁共振氢谱中,Q有两组峰,R有三组峰,Q、R的结构简式为Q ( )、R ( ) 。
(5)A在加热条件下与NaOH溶液反应的化学方程式为( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析