- 原子核外电子排布
- 共93题
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为 。
②NO3-的空间构型 (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①根据等电子原理,CO分子的结构式为 。
②H2O分子中O原子轨道的杂化类型为 。
③1molCO2中含有的σ键数目为 。
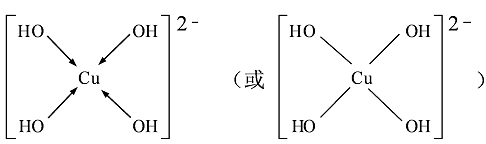
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为 。
正确答案
见解析。
解析
(1)①1s22s22p63s23p63d5(或[Ar]3d5)
②平面三角形
(2)①C≡O ②sp3 ③2×6.02×1023个(或2mol)
(3)
本题科学研究铜锰氧化物作背景,考查学生对电子排布、原子轨道杂化类型与空间构型、等电子体原理、[Cu(OH)4]2-结构等《选修三》基础知识的掌握和应用能力。本题基础性较强,重点特出。
知识点
X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)Y基态原子的电子排布式是________;Z所在周期中第一电离能最大的主族元素是_____。
(2)XY2-离子的立体构型是_______;R2+的水合离子中,提供孤电子对的是原子是______。
(3)Z与某元素形成的化合物的晶胞如右图所示,晶胞中阴离子与阳离子的个数之比是___________。
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是____________。
正确答案
(1)①1s22s22p4
②Cl
(2)①V 形
②O
(3)2:1
(4)2Cu+NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
解析
(1) 通过红棕色气体 XY2 以及氢化物 XH3 推断出 X 为 N 元素, Y 为 O 元素,故 Y 元素的电子排布式为1s22s22p4;通过 Z 的基态原子的 M 层与 K 层电子相等,推断出 Z 原子核外有 12 个电子,故 Z 为 Mg元素,故 Z 所在周期为第三周期,第三周期中第一电离能最大的元素为 Cl 元素;
(2)XY2-为 NO2-离子,中心氮原子采取 sp2杂化,且有一对孤对电子,故空间构型为 V 形;根据 R2+离子的 3d 轨道中有九个电子可知,R 的价电子排布式为 3d104s2,故 R 为 Cu 元素,故水合铜离子中提供故对电子的原子为水分子中的氧原子,铜离子提供给空轨道;
(3)根据晶体图形可知,角上占 1/8,面心占 1/2,体心占 1,故可知晶胞中阴、阳离子个数比为 2:1
(4) 由前两问可知,该反应为 Cu 在浓氨水中与氧气反应生成[Cu(NH3)4](OH)2 的反应方程式,故离子方程式为:2Cu+NH3·H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
知识点
A、B、C、D、E、F均为周期表中前四周期的元素。请按要求回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
下列有关A、B的叙述不正确的是______________。
a,离子半径A<B
b,电负性A<B
c,单质的熔点A>B
d,A、B的单质均能与某些氧化物发生置换反应
e,A的氧化物具有两性
f,A、B均能与氯元素构成离子晶体
(2)C是地壳中含量最高的元素,C基态原子的电子排布式为_______。
(3)E元素原子的最外层电子数是其次外层电子数的2倍,则乙醇分子中E原子的杂化方式是__________。E的一种单质具有空间网状结构,晶胞结构如右图2。已知位于晶胞内部的4个原子,均位于体对角线的

(4)F与硒元素同周期,F位于p区中未成对电子最多的元素族中,F原子的价电子排布
图为_________;
“>”或“<”“=”
正确答案
答案:
(1)bf (2)1s22s22p4 12 (3) sp3
(4)
解析
略
知识点
氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。
(1)基态硼原子的电子排布式为_________。
(2)关于这两种晶体的说法,正确的是_________(填序号)。
a. 立方相氮化硼含有σ键和π键,所以硬度大
b. 六方相氮化硼层间作用力小,所以质地软
c. 两种晶体中的B-N键均为共价键
d. 两种晶体均为分子晶体
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为_________,其结构与石墨相似却不导电,原因是_________。
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为_________。该晶体的天然矿物在青藏高原在下约300Km的古地壳中被发现。根据这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是_________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1mo NH4BF4含有_________mol配位键。
正确答案
(1)1s22s22p1
(2)b、c
(3)平面三角形;层状结构中没有自由移动的电子
(4)sp3;高温、高压
(5)2
解析
略。
知识点
早期发现的一种天然二十面体准晶颗粒由AI.Cu.Fe 三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过 方法区分晶体.准晶体和非晶体。
(2)基态 Fe原子有 个未成对电子,Fe3+的电子排布式为 可用硫氰化钾检验Fe3+,形成的配合物的颜色为_ 。
(3)新制备的Cu(OH)2可将乙醛〔CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为_ ,1mol乙醛分子中含有的σ健的数目为_ 。乙酸的沸点明显高于乙醛,其主要原因是 。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_ 个铜原子。
(4)Al单质为面心立方晶体,,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_ 。列式表示Al单质的密度_ g·cm-3〔不必计算出结果)。
正确答案
(1)X-射线衍射
(2)4 
(3)

6

16
(4) 12

解析
略
知识点
扫码查看完整答案与解析