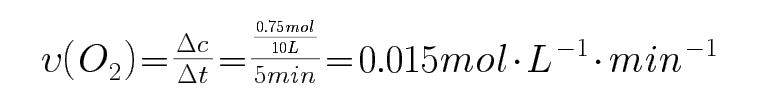- 原子核外电子排布
- 共93题
22.0.9mol
正确答案
解析
A.若为2:3混合的Fe3O4与FeO,二者含有铁元素的物质的量之比为2:1,0.9molFe2O3中含有1.8mol铁离子,根据质量守恒定律,X中含有Fe3O4的物质的量为:0.4mol,含有FeO的物质的量为:0.6mol;根据电子守恒0.4mol Fe3O4完全反应消耗氯气的物质的量为:

B.若为3:5:4混合的Fe3O4、FeO与Fe,三者含有的铁元素的物质的量之比为:9:5:4,则X中含有Fe3O4的物质的量为:0.3mol,含有FeO的物质的量为:0.5mol,含有Fe的物质的量为:0.4mol;0.3molFe3O4完全反应消耗氯气的物质的量为:0.15mol ,0.5molFeO与氯气完全反应消耗氯气的物质的量为:0.25mol,0.4mol铁与盐酸反应生成0.4mol氯化亚铁,0.4mol氯化亚铁完全反应消耗氯气的物质的量为:
C.若为4:5混合的Fe2O3和FeO,二者含有的铁元素的物质的量之比为8:5,则X中含有Fe2O3的物质的量为:


D.若为1:1:4混合的Fe2O3、Fe3O4与FeO,三者含有的铁元素的物质的量之比为:2:3:4,则X中含有Fe3O4的物质的量为:0.2mol,含有FeO的物质的量为:0.8mol,含有Fe2O3的物质的量为:0.2mol;0.2molFe3O4完全反应消耗氯气的物质的量为:0.1mol,0.8molFeO与氯气完全反应消耗氯气的物质的量为:0.4mol,氧化铁与盐酸反应生成氯化铁,氯化铁不与氯气反应,则消耗氯气的总物质的量为:0.1mol+0.4mol=0.5mol,故D正确;
考查方向
氧化还原反应的计算
解题思路
先计算出0.9molFe2O3中含有铁元素的总物质的量,然后分别根据各选项中各组分的物质的量之比及质量守恒定律计算出各组分的物质的量,再根据电子守恒计算出消耗氯气的物质的量即可
易错点
氧化还原中的转移电子守恒的计算
教师点评
本题考查了氧化还原反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力
知识点
6.下列事实或实验可以表明H2SO3的酸性强于H2CO3的是( )
正确答案
解析
A.元素的非金属性越强,其最高价氧化物的水化物酸性越强,硫的非金属性比碳强,则硫酸的酸性大于碳酸,但不能证明亚硫酸酸性大于碳酸,故A错误;
B.SO2气体依次通过NaHCO3溶液、澄清石灰水,澄清石灰水变浑浊,二氧化硫、二氧化碳都能和澄清石灰水反应生成沉淀,该实验现象不能说明亚硫酸、碳酸酸性关系,故B错误;
C.两种气体的溶解度不同,导致其溶液浓度不同,则无法判断酸性强弱,故C错误;
D.室温下测定均为0.1mol/L的NaHSO3和NaHCO3溶液的pH,前者小于后者,说明亚硫酸根离子水解程度小于后者,则证明亚硫酸酸性大于碳酸,故D正确
考查方向
酸性强弱判断
解题思路
强酸能和弱酸盐反应生成弱酸,相同浓度的钠盐溶液,溶液的pH越大其相对应的酸越弱,据此分析解答
易错点
C项:两种气体的溶解度不同,其溶液浓度不同
教师点评
本题考查酸性强弱判断,题目难度中等,明确酸性强弱与其对应酸根离子水解程度关系、非金属氧化物的性质等知识点是解本题关键
知识点
2.下列物质分类正确的是
正确答案
解析
A.NaOH是电解质,Al是单质,不是电解质,故A错误;
B.O2不燃烧,不是易燃气体,故B错误;
C.CaC2能与水反应生成C2H2、K能与水反应生成氢气,C2H2、氢气易燃烧,故C正确;
D.KMnO4、KClO3有强氧化性,是氧化剂,故D错误
考查方向
物质的分类
解题思路
A.电解质是化合物;
B.O2不燃烧,不是易燃气体
C.CaC2能与水反应生成C2H2、K能与水反应生成氢气;
D.KMnO4、KClO3有强氧化性
易错点
B项:O2不燃烧,不是易燃气体
教师点评
本题考查常见危险品标志,难度不大,注意物质的性质和标志的关系
知识点
甲乙两同学分别对含+4价硫元素的物质性质进行了探究。
21.甲用右图装置进行实验(气密性已检验,加热和夹持装置已略去)。实验进行一段时间后,C、D中都出现明显的白色沉淀,经检验均为BaSO4。

进一步实验发现,出现白色沉淀的过程
中,D溶液中NO3-浓度几乎不变。
甲据此得出结论:D中出现白色沉淀的主要原因是 。
22.乙用如下实验对含+4价硫元素的物质性质继续进行探究。


正确答案
① Cu + 2H2SO4(
含+4价硫元素物质(SO2或H2SO3)被O2氧化生成SO42-
解析
①铜和浓硫酸加热发生反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3-浓度几乎不变,说明不是被NO3-氧化的而是被氧气氧化生成硫酸,甲据此得出结论:D中出现白色沉淀的主要原因是酸性溶液中二氧化硫会被氧气氧化生成硫酸,结合钡离子,也能生成硫酸钡沉淀
考查方向
本题考查了物质性质的实验探究
解题思路
①铜和浓硫酸加热发生反应生成硫酸铜、二氧化硫和水;
②出现白色沉淀的过程中,D溶液中NO3-浓度几乎不变说明不是被NO3-氧化的而是被氧气氧化生成硫酸,结合钡离子生成硫酸钡沉淀
易错点
D中出现白色沉淀,易考虑成NO3-在酸性条件下的氧化,但是溶液中的NO3-浓度基本不变成了限定条件,排除此因素,考虑其他因素影响
教师点评
本题考查了物质性质的实验探究,针对现象进行分析,题目难度较大
正确答案
① 2H+ + SO32- === SO2 + H2O (1分);2SO2 + O2 + 2Ba2+ + 2H2O === 2BaSO4↓ + 4H+
(或2H2SO3+O2+2Ba2+ === 2BaSO4↓+ 4H+) ② 含+4价硫元素物质可被O2和浓HNO3氧化③ 0.3 g 纯净Na2SO3和 1.17 g NaCl ii. NO3-的存在可以减慢溶液中+4价硫元素的氧化④ bd
解析
①取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液,产生无色气泡为二氧化硫气体,滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊,说明二氧化硫被空气中氧气氧化生成硫酸,结合钡离子生成硫酸钡白色沉淀,反应的离子方程式为:2H++SO32-═SO2+H2O,2SO2+O2+2Ba2++2H2O═2BaSO4↓+4H+或2H2SO3+O2+2Ba2+═2BaSO4↓+4H+
②由实验1说明空气中氧气也可以氧化+4价硫元素的化合物,实验2说明硝酸溶液中硝酸根离子对氧化反应起到减慢作用,出现沉淀时间长,实验3是浓硝酸能氧化+4价硫元素化合物生成硫酸根离子,出现沉淀快,对比可知氧气、浓硝酸都可以氧化二氧化硫
③探究Cl-和NO3-对其的影响,
i.实验2和4对比,乙获得推论:Cl-的存在可以加快溶液中+4价硫元素的氧化,实验4中需要提供和实验1中相同的氯离子实验探究,即需要0.01L×2mol/L=0.02mol,氯化钠的质量=0.02mol×58.5g/mol=1.17g,对比实验1判断出现沉淀的时间分析,取0.3g 纯净Na2SO3和1.17gNaCl固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液,观察出现沉淀的时间;
ii.实验1和4对比,不同的是盐酸和硝酸,氯离子相同,出现沉淀的时间是盐酸溶液中快,乙获得推论是硝酸根离子减慢+4价硫的化合物的氧化,实验1和4对比,乙获得推论是:NO3-的存在可以减慢溶液中+4价硫元素的氧化;
④实验1可知,取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液,产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊,若含硫酸根离子,加入盐酸和氯化钡溶液会迅速生成白色沉淀,
实验2可知,取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液,产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊,加入硝酸和氯化钡溶液,+4价硫元素化合价被氧气的速率减慢,若有硫酸根离子会迅速生成沉淀
考查方向
本题考查实验方案的分析和设计
解题思路
①取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液,产生无色气泡为二氧化硫气体,滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊,说明二氧化硫被空气中氧气氧化生成硫酸,结合钡离子生成硫酸钡白色沉淀;
②由实验1、2、3对比可知氧气、浓硝酸都可以氧化二氧化硫;
③探究Cl-和NO3-对其的影响,
i.实验2和4对比,乙获得推论:Cl-的存在可以加快溶液中+4价硫元素的氧化,实验4中需要提供和实验1中相同的氯离子实验探究,即需要0.01L×2mol/L=0.02mol,据此和出现沉淀的时间分析;
ii.实验1和4对比,不同的是盐酸和硝酸,氯离子相同,出现沉淀的时间是盐酸溶液中快,乙获得推论是硝酸根离子减慢+4价硫的化合物的氧化;
④对比上述实验确定某溶液中含有SO42-的实验方案是加入盐酸和氯化钡溶液沉淀出现最快,加入硝酸和氯化钡溶液,+4价硫元素化合价被氧气的速率减慢,实验2可知,滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊,若有硫酸根离子会迅速生成沉淀.
易错点
实验现象的对比分析,确定影响反应速率的离子
教师点评
本题考查实验方案的分析和设计、主要是反应现象的不同原因分析判断,实验对比分析是探究实验的常用方法,注意信息提取和现象的理解应用,题目难度较大
大气污染越来越成为人们关注的问题,烟气中的NOx必须脱除(即脱硝)后才能排放,脱硝的方法有多种。
完成下列填空:
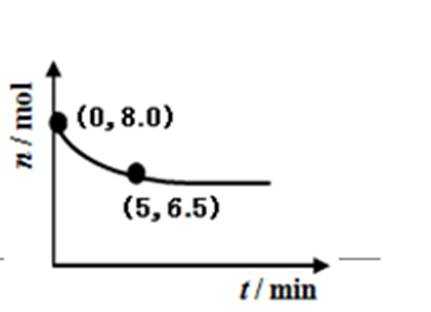
28.(直接脱硝)NO在催化剂作用下分解为氮气和氧气。在10 L密闭容器中,NO经直接脱硝反应时,其物质 ,的量变化如图所示。则0~5min内氧气的平均反应速率为________mol/(L·min)。
29.(臭氧脱硝)O3氧化NO 结合水洗可完全转化为HNO3,此时O3与NO的物质的量之比为_____。
30.(氨气脱硝)实验室制取纯净的氨气,除了氯化铵外,还需要_______、_______(填写试剂名称)。
不使用碳酸铵的原因是_______________________________(用化学方程式表示)。
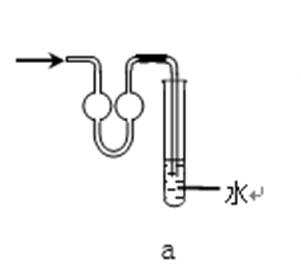
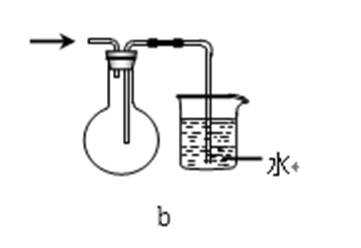
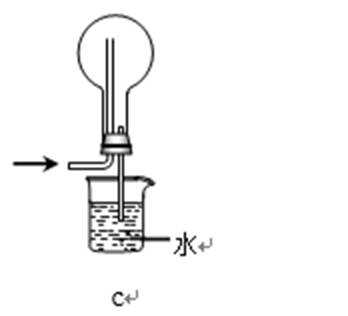
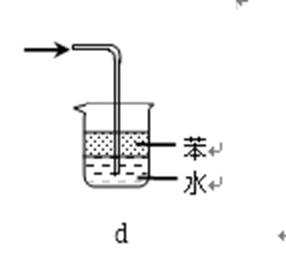
31.吸收氨气时,常使用防倒吸装置,下列装置不能达到此目的的是________。
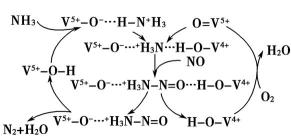
32.NH3脱除烟气中NO的原理如下图:
该脱硝原理中,NO最终转化为________(填化学式)和H2O。
当消耗1mol NH3 和0.25mol O2时,除去的NO在标准状况下的体积为______L。
正确答案
0.015
解析
在10L密闭容器中,根据图示,NO在5min内变化物质的量8.0mol-6.5mol=1.5mol,NO在催化剂作用下分解为氮气和氧气,2NO=O2+N2,生成氧气物质的量0.75mol,则0~5min内氧气的平均反应速率
考查方向
本题考查化学反应速率的计算
解题思路
图象得到NO物质的量变化,计算得到氧气物质的量变化,结合化学反应速率公式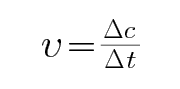
易错点
速率的计算公式是浓度的改变除以时间,易错用物质的量的改变除以时间
教师点评
本题考查化学反应速率的计算,在近几年的各省高考题中出现的频率较高,题目难度不大
正确答案
1: 2
解析
O3氧化NO 结合水洗可完全转化为HNO3,反应的化学方程式为:O3+2NO+H2O=2HNO3,此时O3与NO的物质的量之比为1:2
考查方向
本题考查氧化还原方程式的配平
解题思路
O3氧化NO 结合水洗可完全转化为HNO3,反应的化学方程式为:O3+2NO+H2O=2HNO3
易错点
化合价升降法配平,注意化合价的变化
教师点评
本题考查氧化还原方程式的配平,在近几年的各省高考题中出现的频率较高,侧重于学生能力的考查,题目难度中等
正确答案
熟(消)石灰;碱石灰 (NH4)2CO3 → 2NH3↑+ CO2↑+ 2H2O(2分)
解析
实验室利用固体氯化铵和氢氧化钙加热反应生成,氨气是碱性气体,干燥需要碱性干燥剂,实验室制取纯净的氨气,除了氯化铵外,还需要消(熟)石灰、碱石灰,不使用碳酸铵的原因是碳酸铵加热生成氨气同时会生成二氧化碳气体,反应的化学方程式为:(NH4)2CO3
考查方向
本题考查氨气的实验室制法
解题思路
实验室利用固体氯化铵和氢氧化钙加热反应生成,氨气是碱性气体,干燥需要碱性干燥剂,不使用碳酸铵的原因是碳酸铵加热生成氨气同时会生成二氧化碳气体;
易错点
实验室不能用直接加热氯化铵或碳酸铵的方法制取氨气
教师点评
本题考查氨气的实验室制法,在近几年的各省高考题中出现的频率较高,题目难度不大
正确答案
d
解析
装置abc中都有一个容积较大的仪器,它们能够吸收较多的液体,从而不会使倒吸的液体进入前面的装置,可以防止倒吸,d中导气管插入到水中,氨气极易溶于水,易引起倒吸,不能防倒吸,应是四氯化碳在下层,水在上层,防止倒吸且能吸收氨气
考查方向
本题考查气体的防倒吸装置
解题思路
氨气极易溶于水,在水溶液中易发生倒吸,根据气体压强的知识进行分析;
易错点
防倒吸原理:要有较大的缓冲空间或利用分层液体中的上层液体吸收
教师点评
本题考查气体的防倒吸装置,在近几年的各省高考题中出现的频率较高,题目难度中等
正确答案
N2(1分) 22.4 L(2分)
解析
①由图可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水,所以NO最终转化为N2和H2O;
②氧气、一氧化氮和氨气反应生成氮气和水,反应中氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量,2mol NH3转化为N2失去6mol电子,0.25mol O2得到1mol电子,则NO转化为N2得到的电子为2mol,所以NO的物质的量为1mol,其体积为22.4L;
考查方向
本题考查氧化还原反应及其计算
解题思路
①由图可知反应物为氧气、一氧化氮和氨气最终生成物为氮气和水;
②根据氨气失去的电子的物质的量等于NO和氧气得到的电子总物质的量计算
易错点
得失电子守恒的应用
教师点评
本题考查氧化还原反应及其计算,在近几年的各省高考题中出现的频率非常高,题目难度中等
扫码查看完整答案与解析