- 二氧化硫的污染及治理
- 共21题
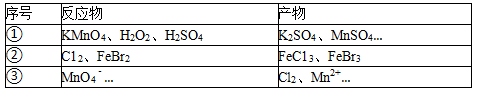
3.根据表中信息判断,下列选项正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23.(1)理论上将SO2通入BaCl2溶液中并不产生沉淀,再通入另一种气体后可以产生白色沉淀.例如通入NO2,写出由SO2生成沉淀的离子反应方程式_________________________。如果通入_________(填化学式)气体,则生成另一种白色沉淀___________(化学式)
(2)实际操作中将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程
则操作①的名称为________,试剂A的化学式为________。
实验表明,加入试剂A后,白色沉淀未见溶解,产生该白色沉淀的离子方程式是 ___________________________。
正确答案
(1)3SO2 +2NO3- +2H2O == 2NO +3 BaSO4 + 4H+NH3 BaSO3
(2)过滤;HCl (3)BaSO4;
2SO2+2Ba2++O2+2H2O===2BaSO4↓+4H+
解析
解析已在路上飞奔,马上就到!
知识点
7.化学
正确答案
知识点
22.[化学—选修2:化学与技术]
(1)硫酸是一种重要的含氧酸。实验室用浓硫酸与乙二酸(H2C2O4)晶体共热,可获得CO 与CO2的混合气体,再将混合气进一步通过 (填一种试剂的名称)即可得纯净干燥的CO。在此反应中,硫酸体现了 性质。
(2)净水丸能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净【Cl2Na(NCO)3】先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。
①优氯净中氯元素的化合价为 。
②亚硫酸钠将水中多余次氯酸除去的离子反应方程式为 。
③亚硫酸钠溶液在空气中易变质,请写出检验亚硫酸钠溶液是否变质的方法 。
(3)某无机盐M是一种优良的氧化剂,为确定其化学式,某小组设计并完成了如下实验:
已知:
①无机盐M仅由钾离子和一种含氧酸根组成,其分子中的原子个数比为2:1:4;
②上图中,将1.98g该无机盐溶于水,滴加适量稀硫酸后,再加入1.12g还原铁粉,恰好完全反应得混合溶液N。
③该小组同学将溶液N分为二等份,分别按路线Ⅰ、路线Ⅱ进行实验。
④在路线Ⅱ中,首先向溶液N中滴加适量KOH至元素X刚好沉淀完全,过滤后将沉淀在空气中充分灼烧得纯净的Fe2O3粉末1.20g;再将滤液在一定条件下蒸干,只得到3.48g纯净的不含结晶水的正盐W。
请按要求回答下列问题:
①由路线Ⅰ的现象可知,溶液N中含有的阳离子是 。
②由实验流程图可推得,含氧酸盐W的化学式是 ;由路线Ⅱ可知,1.98g无机盐M中所含钾元素的质量为 g。
③无机盐M与1.12g还原铁粉恰好完全反应生成溶液N的化学反应方程为 。
正确答案
(1)碱石灰(CaO或NaOH固体),脱水性
(2)①+1价;②SO32-+HClO===SO42-+Cl-+H+
③取适量固体于试管,加水溶解,滴加过量盐酸至无气体放出,再滴加BaCl2,有白色沉淀生成证明试样已经变质。
(3)①Fe2+②K2SO4,0.78g③2Fe+K2FeO4+4H2SO4===3FeSO4+K2SO4+4H2O
解析
(1)硫酸是一种重要的含氧酸,实验室用浓硫酸与乙二酸(H2C2O4)晶体共热,可获得CO与CO2的混合气体,再将混合气进一步通过要得到纯净的CO气体,需要除去混合气体中二氧化碳和水,所以应该用碱石灰干燥;浓硫酸在反应中起到了脱水性,故答案为:碱石灰(CaO或NaOH固体);脱水性;
(2)①优氯净Cl2Na(NCO)3中,钠离子的化合价为+1价,N为-3价、O为-2价、C为+4价,设Cl元素的化合价为x,则:2x+(+1)+3[(-3)+(+4)+(-2)]=0,解得:x=+1,故答案为:+1;
②亚硫酸根离子与次氯酸反应生成硫酸根离子、氯离子,反应的离子方程式为:SO32-+HClO═SO42-+Cl-+H+,故答案为:SO32-+HClO═SO42-+Cl-+H+;
③亚硫酸钠溶液在空气中易变质,则溶液中会存在硫酸根离子,所以判断亚硫酸钠溶液是否变质的方法为:取适量固体于试管,加水溶解,滴加过量盐酸至无气体放出,再滴加BaCl2,有白色沉淀生成证明试样已经变质;无水亚硫酸钠隔绝空气加热到600℃便开始分解,分解产物是硫化钠和另一固体,根据化合价变化可知,另一种产物为Na2SO4,反应的化学方程式为:4Na2SO3═3Na2SO4+Na2S,故答案为:取适量固体于试管,加水溶解,滴加过量盐酸至无气体放出,再滴加BaCl2,有白色沉淀生成证明试样已经变质;4Na2SO3═3Na2SO4+Na2S;
(3)①根据路线Ⅰ可知,N溶液中一定含有亚铁离子,故答案为:Fe2+;
②1.2g氧化铁的物质的量为::1.2g/(160g/mol)=0.0075mol,则溶液中含有铁元素的物质的量为:0.0075mol×2×2=0.03mol,质量为:56g/mol×0.03mol=1.68g>1.12g,所以无机盐M中一定含有Fe元素,无机盐M分子中的原子个数比为2:1:4,则M的化学式为:K2FeO4,根据流程可知,K2FeO4,与稀硫酸、还原铁粉反应生成硫酸亚铁和硫酸钾,根据质量守恒可知W为硫酸钾;
1.98gK2FeO4,的物质的量为1.98g/(198g/mol)==0.01mol,0.01molK2FeO4,中含有0.02mol钾离子,含有钾离子的质量为39g/mol×0.02mol=0.78g,故答案为:K2FeO4 ;0.78;
③无机盐M与还原铁粉反应生成硫酸亚铁、硫酸钾和水,反应的化学方程式为:2Fe+K2FeO4,+4H2SO4═3FeSO4+K2SO4+4H2O,故答案为:2Fe+K2FeO4+4H2SO4═3FeSO4+K2SO4+4H2O。
考查方向
解题思路
(1)除去混合气体中二氧化碳和水,可以选用碱石灰;浓硫酸在该反应中表现了脱水性;
(2)①根据化合物中总化合价为0计算出优氯净 Cl2Na(NCO)3中Cl元素的化合价;
②次氯酸具有强氧化性,能够与亚硫酸根离子发生氧化还原反应;
③亚硫酸钠若变质,溶液中会存在硫酸钠,先用过量盐酸除去亚硫酸根离子,然后用氯化钡检验是否含有硫酸根离子,从而判断亚硫酸钠是否变质;根据化合价变化判断反应产物,写出反应的化学方程式;
(3)1.2g氧化铁的物质的量为:1.2g/(160g/mol)=0.0075mol,则溶液中含有铁元素的物质的量为:0.0075mol×2×2=0.03mol,质量为:56g/mol×0.03mol=1.68g>1.12g,所以无机盐M中一定含有Fe元素,无机盐M分子中的原子个数比为2:1:4,则M的化学式为:K2FeO4,
①路线Ⅰ为检验亚铁离子的方法;
②K2FeO4,与稀硫酸、铁粉反应生成硫酸亚铁、硫酸钾和水,根据质量守恒可知W为硫酸钾;根据n=m/M,计算出K2FeO4,的物质的量,再根据n=nM计算出钾离子的质量;
③根据K2FeO4,与稀硫酸、铁粉反应生成硫酸亚铁、硫酸钾和水写出反应的化学方程式。
易错点
不能熟练应用物质的性质进行杂质处理;不能准确确定复杂化合物的化合价;物质性质把握不准确,不能快速有效提取物质的特征信息进行解题,不能根据守恒法和讨论法进行化合物化学式的计算。
知识点
9.工业产生的废气COX、NOX、SOX 对环境有害,若能合理的利用吸收,可以减少污染,变废为宝。
(1)有一种用CO2生产甲醇燃料的方法:CO2+3H2
已知:CO2(g)+3H2(g) == CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
2H2(g)+O2(g) == 2H2O(l) ΔH=-b kJ·mol-1;
CH3OH(g) == CH3OH(l) ΔH=-ckJ·mol-1;
则表示CH3OH(l)燃烧热的热化学方程式为:____________________。
(2)光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)
①0~6 min内,反应的平均速率v(Cl2)= __________;
②10min改变的条件是__________,该反应平衡常数变化的趋势是__________ (填“增大”、“减小”或“不变”)。
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:
NO2被吸收的离子方程式是____________________。
(4)用粗硅作原料,熔融盐电解法制取硅烷原理如图,判断B为电源的__________极,电解时阳极的电极反应式为____________________。
正确答案
(1)CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-(3b/2-a-c) kJ·mol-1或a+c-3b/2 kJ·mol-1
(2)①0.15 mol·L-1·min-1 ②升高温度 减小
(3) ①2NO2+4HSO3-=N2+4SO42-+4H+
(4) 正 Si+4H--4e-=SiH4 ↑
解析
(1)已知:①CO2(g)+3H2(g) == CH3OH(g)+H2O(l) ΔH=-akJ·mol-1;
②2H2(g)+O2(g) == 2H2O(l) ΔH=-b kJ·mol-1;
③CH3OH(g) == CH3OH(l) ΔH=-c kJ·mol-1;
则表示CH3OH(l)燃烧热的热化学方程式为:②*3/2-①-③=
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) ΔH=-(3b/2-a-c) kJ·mol-1或a+c-3b/2 kJ·mol-1
(2)① 0~6 min内氯气的浓度减少了0.9mol/L,所以反应的平均速率v(Cl2)= 0.15 mol·L-1·min-1
②10min内反应物的浓度增加,生成物的浓度降低,这说明反应向逆反应方向移动,根据左图可知平衡时候身高温度逆反应速度大于正反应速度,即平衡向逆反应方向进行,所以正反应方向是放热反应,改变的条件是升高温度,该反应平衡常数变化的趋势是减小
(3) NO2被吸收转化为氮气,即二氧化氮是氧化剂,亚硫酸氢铵是还原剂,所以该反应的离子方程式是2NO2+4HSO3-=N2+4SO42-+4H+。
(4)H-向右侧移动,这说明右侧电极是阳极, B为电源的正极,电解时阳极的电极反应式为Si+4H--4e-=SiH4 ↑。
考查方向
解题思路
1、根据盖斯定律求算
应用盖斯定律进行简单计算时,关键在于设计反应过程,同时注意:
①参照新的热化学方程式(目标热化学方程式),结合原热化学方程式(一般2~3个)进行合理“变形”,如热化学方程式颠倒、乘除以某一个数,然后将它们相加、减,得到目标热化学方程式,求出目标热化学方程式的ΔH与原热化学方程式之间ΔH的换算关系。
②当热化学方程式乘、除以某一个数时,ΔH也应相应地乘、除以某一个数;方程式进行加减运算时,ΔH也同样要进行加减运算,且要带“+”、“-”符号,即把ΔH看作一个整体进行运算。
③将一个热化学方程式颠倒书写时,ΔH的符号也随之改变,但数值不变。
④在设计反应过程中,会遇到同一物质的三态(固、液、气)的相互转化,状态由固→液→气变化时,会吸热;反之会放热。
(3)根据物质燃烧放热的数值计算:Q(放)=n(可燃物)×|ΔH|
2、解析化学平衡移动题目的一般思路改变条件
易错点
1、外界条件对平衡状态的影响。
2、电解时阳极的电极反应式书写。
知识点
扫码查看完整答案与解析