- 常见气体的制备与收集
- 共133题
25.工业烧碱成分NaOH、Na2CO3和可溶于水但不与酸反应的杂质,工业纯碱成分Na2CO3、NaHCO3和可溶于水但不与酸碱反应的杂质。为测定碱中各成分的百分含量可采用滴定法、气体法等。
完成下列填空:
(1)滴定法测定工业烧碱样品:配制250mL待测液,所用的主要仪器有烧杯、量筒、胶头滴管、玻璃棒、_____________。
(2)测定工业烧碱的总碱量n Na2O(或总耗酸量):进行滴定时,先向盛待测液的锥形瓶中加______________作为指示剂。
判断滴定终点的现象是___________________________。
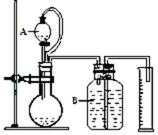
(3)气体法测定工业烧碱的Na2CO3含量(如图):
装置中B部分盛放的试液_______________。
装置中A部分的分液漏斗与烧瓶之间连接的导管所起的作用是__________________________。
(4)用中和滴定的氯化钡法测定工业烧碱中NaOH的含量时,可先在混合液中滴加过量的BaCl2溶液,再以酚酞作指示剂,然后用标准盐酸滴定。
滴加过量的BaCl2溶液目的____________________________________。
向混有碳酸钡沉淀的氢氧化钠溶液中滴入盐酸,为什么不会使碳酸钡溶解而能测定氢氧化钠的含量。_________________________________________________。
(5)用中和滴定的氯化钡法测定工业纯碱中NaHCO3的含量时,使用与测定烧碱相同的实验操作,过程稍作改变即可。
简述该操作过程_________________________________________________。
正确答案
(1)250mL容量瓶、电子天平(药匙)。
(2)甲基橙; 溶液由黄色变为橙色且半分钟不变色
(3)饱和NaHCO3溶液
平衡气体压强便于酸液流下,消除添加酸的体积影响。
(4)使Na2CO3完全变成BaCO3沉淀; 在混合液中滴加盐酸,氢氧化钠与先盐酸反应。滴定终点时溶液呈弱碱性,碳酸钡无法反应。
(5)混合液中加入过量NaOH标准溶液,然后加过量的BaCl2,以酚酞作指示剂用HCl标准溶液滴定过剩的NaOH。
解析
解析已在路上飞奔,马上就到!
知识点
28.某同学对Cl2与KI溶液的反应进行了实验探究。反应装置如下:
通入氯气一段时间,KI溶液变为黄色。继续通入氯气一段时间后,溶液黄色褪去,变为
无色。继续通入氯气,最后溶液变为浅黄绿色。
(1)Cl2与NaOH溶液反应的化学方程式是_______________________。
(2)KI溶液变为黄色说明氯气具有的__________性,该反应的离子方程式_________________________。
(3)已知
① 实验b的目的是______________。
② 根据实验a中,水层中含有的粒子有_______________________。
③ 用化学平衡原理解释实验a中水溶液颜色变浅的原因:_______________________。
④ 为保证实验的严谨性,在实验a、b的基础上,需补充一个实验,该实验为_______________________。
(4)通入氯气,溶液由黄色变为无色,是因为氯气将I2氧化。已知1 mol Cl2可氧化0.2 mol I2,该反应的化学方程式是_______________________。
(5)根据上述实验,请预测向淀粉-KI溶液中持续通入氯气,可能观察到的现象为_______________________。
(6)溶液最终变为浅绿色的原因是_______________________。
正确答案
(1)Cl2+2NaOH=NaCl+NaClO + H2O
(2)氧化性;2I-+Cl2=2Cl-+I2
(3)
① 对比实验,证明实验a中水层显浅黄色是因为存在I2+I-
② I2、I-、I3-、Cl-、K+(可不写H2O、H+、OH-)
③ 由于萃取使水溶液中I2浓度降低,同时I2+I-
④ 取2~3 mL KI溶液,滴加少量的氯水(或通入少量氯气,或加入少量碘单质),再加入足量CCl4,振荡静置,观察到水层是否为黄色。【或取少量实验a的水层溶液滴加AgNO3溶液,观察是否有黄色沉淀生成。或取少量实验a的水层溶液淀粉溶液,观察是否变蓝。】
(4)I2+5Cl2+6H2O
(5)溶液先变蓝后褪色
(6)氯气过量,过量的氯气溶解于水,水中含有氯气分子。
解析
解析已在路上飞奔,马上就到!
知识点
23.某研究小组用下列装置探究SO2与酸性Fe(NO3)3溶液的反应。
请回答:
(1)装置A中反应的化学方程式是_______________。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是________________________。
(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有_________性。
(4)甲乙两同学分析B中产生白色沉淀的原因:
甲同学:在酸性条件下SO2与Fe3+反应;
乙同学:在酸性条件下SO2与NO3-反应;
①按甲同学观点,装置B中反应的离子方程式是__________________,
证明该观点应进一步确认生成的新物质,其实验操作及现象是________________________。
②按乙同学观点,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相
同条件下进行实验。应选择的试剂是(填序号) _________。
正确答案
(l)
(2) 打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹
(3) BaS04 还原性
(4)
取少量B中溶液于试管中,加入适量氢氧化钠溶液,开始产生白色沉淀,白色沉淀
迅速变成灰绿色,最终变为红褐色
② c
解析
解析已在路上飞奔,马上就到!
知识点
23.元素周期表中VIIA元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素原子的电子排布式为____________。
(2)能作为氯、溴、碘元素非金属性递变规律的判断依据是________(填序号)。
a.Cl2、Br2、I2的熔点
b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性
d.HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 

完成I中反应的总化学方程式:



II中转化的基本反应类型是____________,该反应过程能析出KClO3晶体而无其它晶体析出的可能原因是___________________________________。
(4)一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。
D是____________(填微粒名称)。
B → A + C反应的热化学方程式为_________________________(用离子符号表示)。
正确答案
(1)1s22s22p5
(2)b、c
(3)1 NaCl + 3 H2O → 1 NaClO3 + 3 H2↑。
复分解反应
原因是室温下,氯酸钾在水中的溶解度明显小于其它晶体。
(4)D是高氯酸根离子(填微粒名称)。
热化学方程式为3 ClO-(aq) → ClO3-(aq) + 2 Cl—(aq) + 117 kJ(用离子符号表示)。
解析
解析已在路上飞奔,马上就到!
知识点
选考题:请考生从给出的3道化学题题中任选一道做答,如果多做,则每学科按所做的第一题记分。
36.[化学——选修2:化学与技术]
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下:
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为:( )、( )。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是( ),滤渣是( );过滤操作②的滤液是( )和( ),滤渣是( )。
(3)工艺过程中③和④的目的是( )。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是( )。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。
称量草酸成品0.250 g溶于水,用0.0500 mol·L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00 mL,反应的离子方程式为( );
列式计算该成品的纯度( ) 。
37.[化学——选修3:物质结构与性质]
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为( ),该能层具有的原子轨道数为( )、电子数为( )。
(2)硅主要以
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以( )相结合,其晶胞中共有8个原子,其中在面心位置贡献( )个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为( ) 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是( )。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是( ) 。
(6)在硅酸盐中,SiO44-四面体(如右图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为( ) 。Si与O的原子数之比为( ) 。
38.[化学——选修5:有机化学基础]
已知烃B分子内C、H原子个数比为1︰2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系:
(1)B的结构简式是( )
(2)反应①是D与HCl按物质的量之比1︰1的化合反应,则D的分子式是 ( )
反应②可表示为:G + NH3 → F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示):( )
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线
如下:(已知:
(3)甲的结构简式是( )。由甲苯生成甲的反应类型是( )
(4)乙中有两种含氧官能团,反应③的化学方程式是:( )
(5)普鲁卡因有两种水解产物丁和戊 ①戊与甲互为同分异构体,戊的结构简式是( )
②戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式是( )

已知烃B分子内C、H原子个数比为1︰2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系:
(1)B的结构简式是
(2)反应①是D与HCl按物质的量之比1︰1的化合反应,则D的分子式是
反应②可表示为:G + NH3 → F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示):
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知:
(3)甲的结构简式是 。由甲苯生成甲的反应类型是 (1分)
(4)乙中有两种含氧官能团,反应③的化学方程式是:
(5)普鲁卡因有两种水解产物丁和戊 ①戊与甲互为同分异构体,戊的结构简式是
②戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域.该聚合反应的化学方程式是

(2)二氧化硅
(3)共价键 3
(4)Mg2Si+4NH4Cl==SiH4+4NH3+2MgCl2
(5)① ;C—C键和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂。导致长链硅烷难以生成
② C—H键的键能大于C—O键,C一H键比C—O键稳定。而Si—H键的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键
(6)sp3 1 : 3 [SiO3]n2n-(或SiO32-) 38.(1)CH2=CH2
(2)C2H4O; 2CH3CH2Cl + NH3→NH(CH2CH3)2 +2HCl
(3)
(4)
(5)①
②
正确答案
36. (1)
(2)NaOH溶液 CaC2O4 H2C2O4溶液 H2SO4溶液 CaSO4
(3)分别循环利用氢氧化钠和硫酸(降低成本),减小污染 (4)Na2SO4
(5)
正确答案
8.用如图装置做相应实验,
正确答案
D
解析
A.硫化氢、二氧化硫均能具有还原性;
B.氨气的密度比空气的小,应利用向下排空气法收集;
C.二氧化氮与水反应生成硝酸,可氧化KI生成碘单质;
D.氯气与水反应生成盐酸和HClO,均为酸,且HClO具有漂白性;
考查方向
解题思路
A.硫化氢、二氧化硫均能使石灰水变浑浊,则结论应为X可能为二氧化硫,故A错误;
B.氨气的密度比空气的小,应利用向下排空气法收集,图中收集气体的装置不合理,故B错误;
C.二氧化氮密度比空气大,与水反应生成硝酸,可氧化KI生成碘单质,碘遇淀粉变蓝,所以收集方法及所加试剂、现象均正确,结论二氧化氮具有还原性;
D. 氯气与水反应生成盐酸和HClO,均为酸,且HClO具有漂白性,结论应为氯气与水反应生成物具有酸性,HClO具有漂白性;
易错点
本题考查化学实验方案的评价,涉及气体的收集、性质及实验现象分析,侧重物质性质及实验装置中作用的考查,题目难度中等,选项A为易错点。
知识点
13.下列装置可达到实验目的是
正确答案
解析
A.醋酸易挥发,醋酸、碳酸均与苯酚钠反应生成苯酚,则不能比较碳酸、苯酚的酸性,故A错误;
B.乙酸与丁醇加热发生酯化反应生成酯,长导管可冷凝回流,图中可制备乙酸丁酯,故B正确;
C.苯的密度比水小,水在下层,应选分离下层液体,再从长口倒出上层液体,故C错误;
D.蒸干时氯化铵受热分解,应利用冷却结晶法制备,故D错误;
考查方向
化学实验方案的评价
解题思路
A.醋酸易挥发,醋酸、碳酸均与苯酚钠反应生成苯酚;
B.乙酸与丁醇加热发生酯化反应生成酯,长导管可冷凝回流;
C.苯的密度比水小,水在下层;
D.蒸干时氯化铵受热分解
易错点
A项:醋酸易挥发,CO2中混有挥发出的醋酸
教师点评
本题考查化学实验方案的评价及实验装置综合应用,为高频考点,把握物质的性质、实验技能、实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大
知识点
实验室里运用下列实验装置进行实验,能达到相应实验目的并符合环保的是 ( )
正确答案
解析
略
知识点
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅 用此装置和表中提供的物质完成相关实验,最合理的选项是
正确答案
解析
略
知识点
下列说法不正确的是
正确答案
解析
无水CoCl2呈蓝色,只有当硅胶吸收足够的水分,会变成粉红色的CoCl2·6H2O,才失去干燥功能,A错误;温度计只用来测定水浴的温度,若水银球触碰到杯底或杯壁,就变成了灯焰温度了,B正确;锥形瓶内放待测液,残存的蒸馏水对测定结果没有任何影响;但是移液管、滴定管内盛放标准液,若不干燥或润洗,会人为地被稀释而导致误差,C正确,;该实验中容量瓶是配液用的,洗净即可,残存蒸馏水对结果没有影响;利用SO2的还原性,用KMnO4酸性溶液除去,D正确。
知识点
扫码查看完整答案与解析