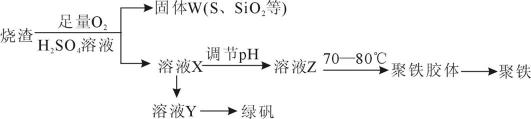- 常见气体的制备与收集
- 共133题
5.用下列实验装置进行相应实验,能达到实验目的的是()
正确答案
解析
A.甲图中装置是排CO2法收集NO。NO和CO2不反应,NO密度比CO2密度小,所以不能用向上排气法收集,故A错误。
B. 乙图中NH3极易溶于水且能和稀硫酸反应,但NH3在水中、稀硫酸中易发生倒吸。虽然氨气不溶于苯,但苯的密度比水小,在稀硫酸溶液的上层,不能起到防止倒吸的作用,故B错误。
C.丙图中阳极为金属铜,不是惰性电极,阳极自身失电子,阳极Cu-2e-=Cu2+。石墨做阴极,2H++2e-=H2 ↑,硫酸钠做电解质,故C正确。
D.温度计测量的是乙醇与二甲醚的蒸汽温度,所以,水银球需在蒸馏烧瓶的支管口处,故D错误。
考查方向
解题思路
A.该图中装置是采用向上排空气法收集NO气体,说明NO和二氧化碳不反应且密度大于CO2密度。
B.氨气是一种无色、有刺激性气味,密度比空气小极易溶于水的气体,且能与硫酸发生化学反应被硫酸吸收,且该装置不能防止倒吸。
C.根据电解池的工作原理,结合电极材料以及电解质溶液解题。
D.温度计的作用应该是测量有机物各馏分气态时的温度。
易错点
收集NO常规方法是用排水法收集,学生易因不熟悉出题角度而选错。
知识点
氨对人类的生产生活具有重要影响。
18.氨的制备与利用。
① 工业合成氨的化学方程式是 。
② 氨催化氧化生成一氧化氮反应的化学方程式是 。
19.氨的定量检测。
水体中氨气和铵根离子(统称氨氮)总量的检测备受关注。利用氨气传感器检测水体中氨氮含量的示意图如下:
① 利用平衡原理分析含氨氮水样中加入NaOH溶液的作用: 。
② 若利用氨气传感器将1 L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4 mol·L-1,则水样中氨氮(以氨气计)含量为 mg·L-1。
20.氨的转化与去除。
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的氮转化系统原理示意图。
① 已知A、B两极生成CO2和N2的物质的量之比为5 : 2,写出A极的电极反应式: 。
② 用化学用语简述NH4+去除的原理: 。
正确答案
① N2 + 3H2
② 4NH3 + 5O2 
解析
①工业合成氨是利用氮气和氢气催化剂作用下高温高压反应生成氨气,反应的化学方程式为:N2+3H2
②氨气的催化氧化生成一氧化氮和水,反应的化学方程式为:4NH3+5O2
考查方向
氨气的制备及应用
解题思路
①工业合成氨是利用氮气和氢气催化剂作用下高温高压反应生成氨气;
②氨气的催化氧化生成一氧化氮和水
易错点
反应条件
教师点评
本题考查氨气的制备及应用,注意基础知识的积累,题目难度不大
正确答案
① c(OH-)增大,使NH4+ + OH- 

② 3.4
解析
①利用平衡原理分析含氨氮水样中加入NaOH溶液的作用是c(OH-)增大,使NH4++OH-⇌NH3•H2O⇌NH3+H2O平衡正向移动,利于生成氨气,被空气吹出
②将1L水样中的氨氮完全转化为N2时,转移电子的物质的量为6×10-4mol,依据氮元素守恒2NH3~N2~6e-,
2NH3~N2~6e-,
2 6
n 6×10-4mol/L
解得:n=2×10-4mol/L
水样中氨氮(以氨气计)含量=2×10-4mol/L×17g/mol=3.4×10-3g/L=3.4mg/L
考查方向
化学平衡、化学计算
解题思路
①氢氧根离子浓度增大会结合铵根离子利于生成氨气;
②若利用氨气传感器将1L水样中的氨氮完全转化为N2时,依据氮元素守恒和电子转移守恒计算水样中氨氮(以氨气计)含量
易错点
化学计算
教师点评
本题主要考查化学平衡影响因素分析和化学计算,题目难度中等
正确答案
① CH3COO- - 8e- + 2H2O === 2CO2 + 7H+
② NH4+在好氧微生物反应器中转化为NO3-:NH4+ + 2O2 === NO3- + 2H+ + H2O;NO3-在MFC电池正极转化为N2:2NO3- +12H+ + 10e- === N2 + 6H2O
解析
①图示分析可知微生物燃料电池中氢离子移向B电极,说明A为原电池的负极,B为原电池的正极,NO3-离子在正极得到电子生成氮气发生还原反应,CH3COO-在原电池负极失电子生成二氧化碳气体,发生氧化反应,环境为酸性介质,则A极的电极反应式为:CH3COO--8e-+2H2O═2CO2+7H+,B电极反应式为:2NO3-+12H++10e-═N2+6H2O,
②NH4+在好氧微生物反应器中转化为NO3-,NH4++2O2═NO3-+2H++H2O,硝酸根离子在原电池正极发生还原反应生成氮气,2NO3-+12H++10e-═N2+6H2O,
考查方向
原电池原理、电极反应
解题思路
①图示分析可知微生物燃料电池中氢离子移向B电极,说明A为原电池的负极,B为原电池的正极,NO3-离子在正极得到电子生成氮气发生还原反应,CH3COO-在原电池负极失电子生成二氧化碳气体,发生氧化反应,环境为酸性介质;
②NH4+在好氧微生物反应器中转化为NO3-,硝酸根离子在原电池正极发生还原反应生成氮气.
易错点
电极反应
教师点评
本题主要考查原电池原理和电极反应,题目难度中等,注意得失电子的分析
仅用下表提供的玻璃仪器(非玻璃仪器任选)就能实现相应实验目的的是
正确答案
解析
本题 涉及的实验全部取材于课本,主要考查常见实验仪器的使用方法、溶液pH与c(H+)的换算,同时考查考生对基本化学实验的操作能力及其教材实验的再现能力。让真正做过实验的考生能发挥其优势。
A选项:乙酸乙酯和乙醇是互溶不分层的液体,不能用分液漏斗分液。欲从乙酸乙酯和乙醇的混合物中分离出乙 醇,通常需要蒸馏分离(由于乙酸乙酯和乙醇的沸点相差很小,乙酸乙酯的沸点77.06℃,乙醇的沸点78℃,通常要加足量无水CaCl2吸收乙醇后,再蒸馏,对得到的醇和物蒸馏收集得到乙醇)。
B选项:由0. 1 mol •L-1的盐酸配制100 mL 0. 01 mol •L-1的盐酸,需要用酸式滴定管(或移液管)准确量取10.0 mL0. 1 mol •L-1的盐酸,而提供玻璃仪器缺少量具。
C选项:只用试管、胶头滴管就可证明溴水、淀粉-KI溶液比较Br2与I2的氧化性强弱。故C项正确。
D选项:实验室中用NH4Cl固体和Ca(OH)2固体制备并收集NH3需要用到的玻璃仪器有大试管、酒精灯、导管、集气瓶,而提供玻璃仪器缺少制备NH3的大试管。
知识点
聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O)的过程如下:
(1)验证固体W焙烧后产生的气体含有SO2的方法是_________。
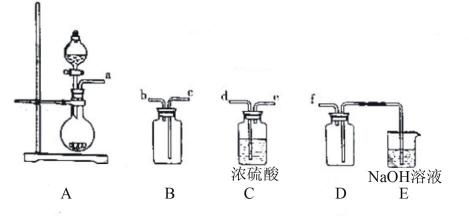
(2)实验室制备、收集的SO2,所需仪器如下。装置A产生SO2 , 按气流方向连接各仪器接口,顺序为a→ → → → →f,,装置D的作用是_________,装置E中NaOH溶液的作用是___________
(3)制备绿矾时,向溶液X中加入过量__________,充分反应后,经___________操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。
(4)溶液Z的pH影响聚铁的质量分数,用pH试纸测定溶液pH的操作方法为_____________。若溶液Z的pH偏小,将导致聚铁由铁的质量分数偏______________。
正确答案
(1)将气体通入品红溶液中,如品红褪色,加热后又变红,证明有SO2。
(2)d e c b;安全瓶,防止倒吸;尾气处理,防止污染
(3)铁粉;过滤。
(4)将试纸放到表面皿上,用玻璃棒蘸取溶液,点到试纸的中央,然后跟标准比色卡对比。低。
解析
(1)检验SO2的方法一般是:将气体通入品红溶液中,如品红褪色,加热后又变红。
(2) 收集干燥的SO2,应先干燥,再收集(SO2密度比空气的大,要从c口进气),最后进行尾气处理;因为SO2易与NaOH反应,故D的作用是安全瓶,防止倒吸。
(3)因为在烧渣中加入了硫酸和足量氧气,故溶液Y中含有Fe3+,故应先加入过量的铁粉,然后过滤除去剩余的铁粉。[来源:学科网]
(4)用pH试纸测定溶液pH的操作为
Fe(OH)3的含铁量比Fe2(SO4)3高,若溶液Z的pH偏小,则生成的聚铁中OH-的含量减少,
SO42-的含量增多,使铁的含量减少。
知识点
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅 用此装置和表中提供的物质完成相关实验,最合理的选项是
正确答案
解析
略
知识点
实验室进行下列实验,在选择实验装置时应当考虑冷凝回流装置的是()
正确答案
解析
略
知识点
请回答下列实验室中制取气体的有关问题。
(1)下图是用KMnO4与浓盐酸反应制取适量氯气的简易装置。
装置B、C、D的作用分别是:
B:_________________________________。
C:_________________________________。
D:_________________________________。
(2)在实验室欲制取适量N0气体。
①下图中最适合完成该实验的简易装置是________(填序号);
②根据所选的装置完成下表(不需要的可不填):
③简单描述应观察到的实验现象_______________________________________。
正确答案
见解析。
解析
(1)气体制备一般包括四部分:发生装置、除杂净化装置、收集装置、尾气处理装置。由于题中提到该装置是制取适量氯气的简易装置,所以B的作用是除去Cl2中混有的杂质气体HCl;C的作用是用排液法收集氯气;D的作用是吸收多余的氯气;
(2)①由于NO可与空气中的氧气反应,故应用排水法收集,那么最适宜完成该实验的简易装置是Ⅰ。
②
③现象包括看到的、听到的、闻到的、触摸到的。A处试管内有气泡产生,铜片减少,溶液变蓝,试管上部有红棕色的气体,一段时间后B中液体排出后可以收集到无色气体。
知识点
下列实验操作或装置(略去部分加持仪器)正确的是
正确答案
解析
略
知识点
实验室制备下列气体时,所用方法正确的是
正确答案
解析
略
知识点
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
正确答案
解析
该装置分别为固液不加热制气体,向上排空气法收集气体,以及采用防倒吸的方法进行尾气处理。A、氨气不能使用向上排空气法,错误;B、正确;C、铜与稀硝酸反应需要加热,且
知识点
扫码查看完整答案与解析