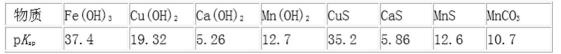- 常见金属的活动性顺序及其应用
- 共63题
10.软锰矿(主要成分为MnO2)可用于制备锰及其化合物。
(1)早期冶炼金属锰的一种方法是先煅烧软锰矿生成Mn3O4,再利用铝热反应原理制得锰,该铝热反应的化学方程式为 。
(2)现代冶炼金属锰的一种工艺流程如下图所示:

下表为t℃时,有关物质的pKsp(注:pKsp =-lgKsp)。
软锰矿还原浸出的反应为:
12MnO2 + C6H12O6 + 12H2SO4=12MnSO4 + CO2↑+18H2O
①该反应中,还原剂为_______。写出一种能提高还原浸出速率的措施: 。
②滤液1的pH (填“>”、“<”或“=”)MnSO4浸出液的pH。
③加入MnF2的主要目的是除去 (填Ca2+、Fe3+或Cu2+)
(3)由MnSO4制取MnCO3往MnSO4溶液中加入过量NH4HCO3溶液,,该反应的离子方程式为_________________________;若往MnSO4溶液中加入(NH4)2CO3溶液,还会产生Mn(OH)2,可能的原因有:MnCO3(s) + 2OH-(aq) 
正确答案
(1)8Al + 3Mn3O4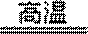
(2)①C6H12O6 升高反应温度(或将软锰矿研细等其他合理答案)②>③Ca2+(3)Mn2+ + 2HCO3-=MnCO3↓+ H2O + CO2↑ 100
解析
(1)高温下,Al和Mn3O4发生铝热反应生成Mn,根据反应物、生成物及反应条件书写方程式为8Al + 3Mn3O4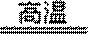
(2)软锰矿还原浸出得到硫酸锰溶液,说明浸取液为稀硫酸,同时溶液中还含有Ca2+、Fe3+、Cu2+等杂质,调节溶液的pH,Fe(OH)3的PKsp为37.4与其它离子相比最大,调节pH可以将 Fe(OH)3沉淀下来,向滤液中加入硫化铵,CuS的pKsp为35.2,可以将铜离子形成硫化物沉淀下来,再加入MnF2,形成CaF2沉淀,除去Ca2+,最后对得到的含有锰离子的盐电解,可以得到金属锰,
①软锰矿还原浸出的反应为:12MnO2+C6H12O6+12H2SO4═12MnSO4+6CO2↑+18H2O,该反应中,Mn元素化合价由+4价变为+2价、C元素化合价由0价变为+4价,失电子化合价升高的反应物是还原剂,所以C6H12O6为还原剂;反应物接触面积越大、温度越高反应速率越快,所以能提高还原浸出速率的措施:升高反应温度或将软锰矿研细等;
②软锰矿还原浸出的反应为:12MnO2+ C6H12O6+12H2SO4=12MnSO4+CO2↑+18H2O,溶液呈强酸性,还原浸出液中含有Mn2+、Ca2+、Fe3+、Cu2+,此时未形成沉淀, pKsp=-1gKsp,pKsp越大,沉淀溶解平衡常数越小,滤液1为形成Fe(OH)3沉淀,pKsp=-1gKsp=37.4,Ksp=10-37.4,Ksp=c(Fe3+)×c3(OH-)=10-37.4,c(OH-)≈10-10,c(H+)=1×10-4mol/L,pH=4,所以滤液1的pH大于MnSO4浸出液的pH=4才能形成氢氧化铁沉淀,故答案为:>;
③CaF2难溶于水,滤液2中含有Mn2+、Ca2+、NH4+、SO42-,加入MnF2的目的是形成CaF2沉淀,除去Ca2+;
(3)锰离子和碳酸氢根离子反应生成碳酸锰沉淀、水和二氧化碳气体,离子方程式为Mn2++2HCO3-=MnCO3↓+H2O+CO2↑;
由MnCO3(s) + 2OH-(aq)
K=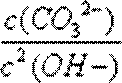


考查方向
本题主要考查化工流程、氧化还原反应、合金及其他金属难溶电解质的溶解平衡等相关知识。
解题思路
学会找关键词、关键数据、关键反应等题供的重要信息。把每一个流程分析透彻是得分的关键。比如该题流程中的调节PH的目的是将铁离子和铜离子转化成氢氧化物沉淀;加入MnF2,形成CaF2沉淀,除去Ca2+等。
易错点
审题不清、甚至题目都没看懂;每一步骤发生的反应及其变化分析不清。
知识点
10.钼(Mo)是一种过渡金属元素,通常用作合金及不镑钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备 金属钼的主要流程图,已知钼酸难溶于水。








正确答案
(1)2MoS2+7O2
(2)MoO3+2NH3·H2O=(NH4)2MoO4↓+2H2O
(3)CD 2CO32-+SO2+H2O=2HCO3-+SO32-
(4)烧杯、漏斗、玻璃棒
(5)41.1
解析
(1)二硫化钼与氧气在高温下反应生成三氧化钼和二氧化硫,所以反应方程式为:2MoS2+7O2
(2)由流程中信息可知MoO3是酸性氧化物,与NH3·H2O反应生成难溶性盐和水,所以反应方程式为:MoO3+2NH3·H2O=(NH4)2MoO4↓+2H2O;
(3)由于酸性H2SO3大于H2CO3、所以H2SO3可以与HCO



(4)操作1和操作2都是分离固体与液体混合物,都是过滤操作,所以需要的仪器有烧杯、漏斗、玻璃棒;
(5)根据反应方程式知,1 mol甲烷完全反应生成4 mol还原性气体,而:3CO+MoO3

考查方向
以化工生产中制备金属钼的流程图为载体,考查化学方程式、离子方程式的书写以及离子的共存的判断;通过实验基本操作考查实验仪器的使用,利用守恒法和关系式法进行简计算。
解题思路
(1)二硫化钼与氧气在高温下反应生成三氧化钼和二氧化硫。
(2)由流程中信息可知MoO3是酸性氧化物,与NH3·H2O反应生成难溶性盐和水;
(3)由于酸性H2SO3大于H2CO3、所以H2SO3可以与HCO



(4)操作1和操作2都是分离固体与液体混合物,都是过滤操作。
(5)根据反应方程式知,1 mol甲烷完全反应生成4 mol还原性气体,而:

易错点
(1)不注意对方程式配平;(2)没有捕捉图中信息,(NH4)2MoO4是沉淀,漏写沉淀符号;(3)没有理解弱酸的平衡常数与酸性强弱的关系致错,由于通人少量二氧化硫,所以只能完成亚硫酸的第一步电离过程;(4)不了解操作1和操作2的分离实质;(5)不能利用守恒法和关系式法进行简计算
知识点
20.已知:Ksp(CuS)=1.3×10-36mol2/L2,Ksp(MnS)=2.6×10-13mol2/L2。工业生产中常用MnS作为沉淀剂,除去工业废水中的Cu2+:Cu2+(aq)+MnS(s)=CuS(s)+Mn2+(aq),下列说法错误的是
正确答案
解析
A.MnS是固体,所以增大使用量,平衡不移动,因此MnS使用量越大,不能增大废水中的Cu2+的去除率,A错误;B.当废水中的Cu2+浓度小于10-5时,就可以看作沉淀完全,B正确;C.往平衡体系中加入少量CuSO4固体后,溶液中铜离子浓度增大,平衡正向移动,所以c(Mn2+)变大,C正确。D.该反应的平衡常数K=


考查方向
解题思路
A.MnS是固体,所以增大使用量,平衡不移动。B.当废水中的Cu2+浓度小于10-5时,就可以认为沉淀完全,C.往平衡体系中加入少量CuSO4固体后,溶液中铜离子浓度增大,平衡正向移动,所以c(Mn2+)变大。D.该反应的平衡常数K=


易错点
固体的浓度是一个常数.改变固体或纯液体的量不会影响化学平衡、当废水中的Cu2+浓度小于10-5时,就可以认为沉淀完全。
知识点
9.下列各组离子可以大量共存的是
正确答案
考查方向
解题思路
A. 遇酚酞变红的溶液含有OH-
B. 常温下Kw/c(H+)=1×10-13mol/L的溶液中, Kw/c(H+)=c(OH-)
C. 水电离出的c(H+)=10-10mol/L的溶液即显酸性又显碱性。
D.AlCl3溶液中铝离子水解显酸性。
易错点
Kw/c(H+)=1×10-13mol/L的溶液中, Kw/c(H+)=c(OH-)
水电离出的c(H+)=10-10mol/L的溶液即显酸性又显碱性
知识点
7.通常用于金属制品表面防腐的“银粉”,实际上是下列哪种金属的粉末
正确答案
解析
A.Al是银白色金属,表面可以形成一层致密的氧化膜,阻碍铝被进一步氧化,是常用于金属制品表面防腐的“银粉”,A正确;
B.Mg是银白色金属,易被空气中氧气氧化,不能用于金属制品表面防腐,B错误;
C.Cu是紫红金属,可以和空气中氧气、二氧化碳、水反应生成铜锈,不能用于金属制品表面防腐,C错误;
D.Au是金黄色金属,在空气中不能被氧化,但价格昂贵,不用于金属制品表面防腐,D错误;
故选A。
考查方向
解题思路
A.Al是银白色金属,表面可以形成一层致密的氧化膜,阻碍铝被进一步氧化;
B.Mg是银白色金属,易被空气中氧气氧化;
C.Cu是紫红金属,可以和空气中氧气、二氧化碳、水反应生成铜锈;
D.Au是金黄色金属,在空气中不能被氧化,但价格昂贵;
易错点
Mg也是银白色金属,但易被空气中氧气氧化,不能用于金属制品表面防腐,
知识点
扫码查看完整答案与解析