- 常用仪器及其使用
- 共81题
10.利用表中提供的仪器和药品,能达到相应实验目的的是
正确答案
D
解析
A、氢氧化铁胶体的制备需要将饱和氯化铁溶液加入沸水中;所以需要酒精灯加热,所以A错误;
B、干燥的二氧化碳气体在水中溶解度较小,不能形成喷泉,所以B错误;
C、氢氧化钠溶液浓度的测定过程中要量取氢氧化钠溶液的体积,终点的判断需要指示剂,缺少指示剂和碱式滴定管,所以C错误;
D、蒸发溶液得到氯化钠晶体要在蒸发皿中进行,要用蒸发皿,蒸发皿可以直接加热,不需要垫石棉网,所以D正确。
考查方向
解题思路
A、氢氧化铁胶体的制备需要将饱和氯化铁溶液加入沸水中;
B、干燥的二氧化碳气体在水中溶解度较小,不能形成喷泉;
C、氢氧化钠溶液浓度的测定过程中要量取氢氧化钠溶液的体积,终点的判断需要指示剂,缺少指示剂和锥形瓶、碱式滴定管,不能作滴定实验,错误;
D、蒸发溶液得到氯化钠晶体要在蒸发皿中进行,要用蒸发皿,蒸发皿可以直接加热,不需要垫石棉网,
易错点
选项C为易错点,注意操作的可行性、评价性分析。
知识点
醋酸亚铬水合物{[Cr(CH3COO)2]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如图所示,且仪器2中预先加入锌粒。已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+ 2HCl(aq)= ZnCl2(aq)+ H2(g)
2CrCl3(aq)+ Zn(s) = 2CrCl2(aq)+ ZnCl2(aq)
2Cr2+(aq)+ 4CH3COO-(aq)+ 2H2O(l)= [Cr(CH3COO)2]2·2H2O(s)
请回答下列问题:
8.仪器1的名称是 。
9.往仪器2中加盐酸和三氯化铬溶液的顺序最好是 (选下面的A、B或C);目
的是 。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液一段时间后再加盐酸
C.先加盐酸一段时间后再加三氯化铬溶液
10.为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门 (填“A”或“B”,下同),打开阀门 。
11.本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是 。
12.已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 9.48g,则该实验所得产品的产率为 (不考虑溶解的醋酸亚铬水合物)。
正确答案
分液漏斗
解析
由图可知,仪器1的名称是分液漏斗。
考查方向
解题思路
根据仪器结构特征,判断仪器1的名称。
易错点
本题考查物质制备实验方案的设计,题目难度中等,涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算、对信息的获取与运用等知识,注意对题目信息的应用,有利于培养学生分析、理解能力及化学实验能力。
正确答案
C
让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化
解析
二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出,避免生成的亚铬离子被氧化,故先加盐酸一段时间后再加三氯化铬溶液,故选C。
考查方向
解题思路
二价铬不稳定,极易被氧气氧化,让锌粒与盐酸先反应产生H2,把装置2和3中的空气赶出。
易错点
本题考查物质制备实验方案的设计,题目难度中等,涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算、对信息的获取与运用等知识,注意对题目信息的应用,有利于培养学生分析、理解能力及化学实验能力。
正确答案
B A
解析
为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门B,打开阀门A,Zn和HCl反应生成氢气,压强增大,CrCl2溶液从容器2进入容器3。
考查方向
解题思路
利用生成氢气,使装置内气体增大,将CrCl2溶液压入装置3中与CH3COONa溶液顺利混合。
易错点
本题考查物质制备实验方案的设计,题目难度中等,涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算、对信息的获取与运用等知识,注意对题目信息的应用,有利于培养学生分析、理解能力及化学实验能力。
正确答案
使锌与CrCl3充分反应得到CrCl2
解析
本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是使锌与CrCl3充分反应得到CrCl2
考查方向
解题思路
过量的锌与CrCl3充分反应得到CrCl2
易错点
本题考查物质制备实验方案的设计,题目难度中等,涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算、对信息的获取与运用等知识,注意对题目信息的应用,有利于培养学生分析、理解能力及化学实验能力。
正确答案
84.0%
解析
CrCl3的物质的量为:


考查方向
解题思路
CrCl3为0.06mol,得到CrCl2为0.06mol,而CH3COONa为0.15mol,由方程式可知CH3COONa足量,根据CrCl2计算22H2O 的理论产量,进而计算其产率。
易错点
本题考查物质制备实验方案的设计,题目难度中等,涉及化学仪器识别、对操作的分析评价、产率计算、溶度积有关计算、对信息的获取与运用等知识,注意对题目信息的应用,有利于培养学生分析、理解能力及化学实验能力。
侯德榜是我国著名科学家,1933年出版《纯碱制造》一书,创立了中国自己的制碱
工艺。其纯碱制造原理如下图所示:
19.由NaHCO3制备纯碱的化学方程式是 。
20.过程Ⅰ通入NH3和CO2的顺序是 。
21.过程Ⅱ析出NH4Cl(s)的原因是 。
22.充分利用副产品NH4Cl生产NH3和HCl。直接加热分解NH4Cl,NH3和HCl的产率
往往很低,原因是 。
23.采用MgO循环分解NH4Cl。加热,在300℃以下获得NH3;继续加热至350℃~600℃获得HCl气体。利用下列装置(加热及加持装置略)可测量NH3和HCl的产率。
① 低于300℃时,干燥管盛装的干燥剂是 。NH3吸收完全后,更换干燥剂和吸收装置中的吸收液。
② 产生NH3的化学反应方程式是 。
③ 在350℃~60
④ MgO可以循环分解NH4Cl制得NH3和HCl的原因是 (结合化学方
程式解释)。
正确答案
2NaHCO3
正确答案
先通NH3,后通CO2 (2 分)
正确答案
NH4Cl(s) 
正确答案
NH3 + HCl = NH4Cl (2 分)
正确答案
① 碱石灰 (1分)
② MgO + 2NH4Cl 
③ c (1 分)


MgCl2+2H2O Mg(OH)2+2HCl↑;Mg(OH)2受热生成MgO,Mg(OH)2 MgO+H2O,
所以MgO可以循环应用与NH4Cl反应制得NH3和HCl。 (2 分)
题: (NH4)2Fe(SO4)2·6H2O(M=392g·mol—1)又称莫尔盐,简称FAS,其俗名来源于德国化学家
莫尔(Karl Friedrich Mohr)。它是浅蓝绿色结晶或粉末,对光敏感,在空气中会逐渐风化及氧化,可溶于水,几乎不溶于乙醇。某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度。
莫尔盐的制取
回答下列问题:
8.步骤②必须在剩余少量铁屑时进行过滤,其原因是 。
9.制取的莫尔盐最后要用 洗涤(填字母编号)。 a.蒸馏水 b.乙醇 c.滤液
10.从下图中选取必须用的仪器连接成实验室制取(NH4)2SO4溶液的装置,连接的顺序
(用接口字母表示)是_____________。
正确答案
防止Fe2+被氧化
解析
Fe2+离子不稳定,易被氧气氧化为Fe3+离子,剩余少量铁粉防止Fe2+离子被氧化为Fe3+离子
考查方向
Fe2+、Fe3+的性质
解题思路
Fe2+离子不稳定,易被氧气氧化为Fe3+离子,剩余少量铁粉防止Fe2+离子被氧化为Fe3+离子
易错点
Fe2+、Fe3+的氧化还原
教师点评
本题考查Fe2+、Fe3+的性质,注意基础知识的理解掌握,题目难度不大
正确答案
b (1分。多填0分)
解析
乙醇易挥发,用少量酒精来洗去晶体表面杂质,用水会使摩尔盐溶解损失,用滤液会带入杂质,用乙醇会除去晶体表面水分,加速晶体的干燥,防止其氧化变质
考查方向
沉淀的洗涤
解题思路
乙醇易挥发,少量酒精来洗去晶体表面杂质
易错点
用水会使摩尔盐溶解损失
教师点评
本题考查沉淀的洗涤,题目难度中等,需要学生运用知识分析解决问题的能力
正确答案
a接d,e接f或a、d,e、f或a→d,e→f(2分。表述清楚即可。有错即0分)。
解析
制取的氨气与硫酸反应生成硫酸铵,剩余的氨气用水吸收,故连接顺序为a→d→e→f
考查方向
制备实验方案的设计
解题思路
制取的氨气与硫酸反应生成硫酸铵,剩余的氨气用水吸收
易错点
将B装置连接上
教师点评
本题考查制备实验方案的设计、注意结合装置特点分析,题目难度中等
下列说法不正确的是
正确答案
解析
由于量筒的精确度只到0.1ml,配出来的溶液只能精确到0.1mol/L,所以C不正确。这题属于实验化学,常识题。
知识点
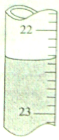
用0.1026mol·L-1的盐酸滴定25.00mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如下图所示,正确的读数为
正确答案
解析
图中液面在22~23mL之间,分刻度有10个,因而每刻度是0.1mL,液体的凹面读数约为22.35mL。
知识点
下列说法正确的是
正确答案
解析
略
知识点
茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是( )
正确答案
解析
略
知识点
Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
一,制备Na2S2O3•5H2O
反应原理:Na2SO3(aq)+S(s)
实验步骤:
① 称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml 乙醇润湿,加入上述溶液中。
② 安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。
③ 趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3•5H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是 。
(2)仪器a的名称是 ,其作用是 。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是 ,检验是否存在该杂质的方法是 。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:
。
二, 测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol•L‾1碘的标准溶液滴定。
反应原理为:2S2O32‾+I2=S4O62-+2I‾
(5)滴定至终点时,溶液颜色的变化: 。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为 mL。产品的纯度为(设Na2S2O3•5H2O相对分子质量为M) 。
三, Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42‾,常用作脱氧剂,该反应的离子方程式为 。
正确答案
(1)使硫粉易于分散到溶液中
(2)冷凝管 冷凝回流
(3)
取少量产品溶于过量稀盐酸,过滤,向滤液中甲
(4)
(5)由无色变蓝色
(6)18.10
(7)
解析
略
知识点
根据废水中所含有害物质的不同,工业上有多种废水的处理方法。
(1)①废水I若采用CO2处理,离子方程式是_______。
②废水Ⅱ常用明矾处理。实践中发现废水中的c(HCO3-)越大,净水效果越好,这是因为_______。
③废水III中的汞元素存在如下转化(在空格上填相应的化学式):Hg2++_______=CH3Hg++H+我国规定,Hg2+的排放标准不能超过0.05 mg/L。若某工厂排放的废水1 L中含Hg2+3×10-17mo1,是否达到了排放标准_______(填“是”或“否”)。
④废水Ⅳ常用C12氧化CN—成CO2和N2,若参加反应的C12与CN—的物质的量之比为5:2,则该反应的离子方程式为_______。
(2)化学需氧量(COD)可量度水体受有机物污染的程度,它是指在一定条件下,用强氧化剂处理水样时所消耗的氧化剂的量,换算成氧的含量(以mg/L计)。某研究性学习小组测定某水样的化学需氧量(COD),过程如下:
I,取V1mL水样于锥形瓶,加入10.00 mL 0.2500 mol·L-1 K2Cr2O7溶液。
II,加碎瓷片少许,然后慢慢加入硫酸酸化,混合均匀,加热。
III,反应完毕后,冷却,加指示剂,用c mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液滴定。终点时消耗硫酸亚铁铵溶液V2 mL。
①I中,量取K2Cr2O7,溶液的仪器是_______。
②III中,发生的反应为:Cr2O72-+6Fe2++14 H+=2Cr3++6Fe3++7H2O,由此可知,该水样的化学需氧量COD=_______(用含c、V1、V2的表达式表示)。
正确答案
(1)①OH-+CO2=HCO3-
②HCO3-会促进Al3+的水解,生成更多的Al(OH)3,净水效果增强
③CH4;是
④5 Cl2+2CN-+4H2O;10Cl-+2CO2+N2+8H+
(2)①酸式滴定管(或移液管);②
解析
(1)①据题意知废水I呈碱性,因此OH-+CO2=HCO3-,溶液的pH接近7。②HCO3-与铝离子发生相互促进的水解反应,使得产生更多的氢氧化铝沉淀。③利用元素守恒可知反应物为甲烷,
(2)①K2Cr2O7具有强氧化性应该用酸式滴定管或是移液管。②Cr2O72-+6Fe2++14 H+=2Cr3++6Fe3++7H2O,水样中的Cr2O72-为cV2×10-3×



知识点
扫码查看完整答案与解析