- 有关范围讨论题的计算
- 共11题
3.下列说法中正确的是()
正确答案
解析
A.使石蕊溶液呈红色的溶液呈酸性,酸性条件下Fe2+、Cr2O72﹣发生氧化还原反应,故A错误;
B.应为Ba2++2OH﹣+2H++SO42﹣=BaSO4↓+2H2O,故B错误;
C.pH=﹣lgc(H+)=1,则c(H+)=0.1mol/L,故C正确;
D.NaHCO3水解程度最小,CH3COONa浓度应最大,故D错误.
考查方向
解题思路
A.酸性溶液使石蕊溶液呈红色;
B.OH-+H+数比为2:2;
C.根据pH=﹣lgc(H+)计算;
D.CH3COONa水解程度最小,浓度应最大.
易错点
离子共存,离子方程式的书写以及pH的计算。
知识点
Ⅰ.
13.在一密闭容器中一定量A、B的混合气体发生反应:aA(g)+bB(g)
平衡时测得A的浓度为0.60mol/L,保持温度不变,将容器的容积扩大到原来的3倍,再达平衡时,测得A的浓度降为0.20mol/L。下列有关判断一定正确的是( )
A.平衡向正反应方向移动
B.A的转化率增大
C.D的体积分数增大
D.a+b<c+d
14.①25℃,两种酸的电离平衡常数如表。
HSO3-的电离平衡常数表达式K= 。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
③根据H2SO3的电离常
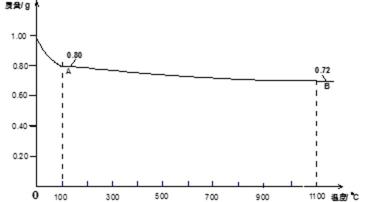
15.Ⅱ.0.98gCu(OH)2样品受热分解的热重曲线(样品质量随温度变化的曲线)如图所示。
请回答下列问题:
试确定1100℃时所得固体B的化学式(要求写出推理或计算过程)。
16.固体A在一定条件下能与一种能使湿润的红色石蕊试纸变蓝的气体反应,得到红色固体单质和气体单质,则该反应的化学方程式为 ;若反应中转移0.015mol电子,则消耗还原剂的物质的量为 。
17.取少量固体B于试管中,加入足量的稀硫酸得到蓝色溶液,同时观察到试管中还有红色固体存在,该反应的离子方程式为 。
正确答案
D
解析
A. 保持温度不变,将容器的体积扩大两倍,如平衡不移动,A的浓度为0.3mol/L,实际A的浓度变为0.2mol/L,说明平衡向消耗A的方向移动,即向正反应移动;
B. 平衡向消耗A的方向移动,即A的转化率增大;
C. 平衡向正反应移动,减小压强平衡向气体物质的量减小的方向移动,气体的物质的量减小;
D.平衡向正反应移动,压强平衡向气体物质的量减小的方向移动,a+b
考查方向
解题思路
保持温度不变,将容器的体积扩大两倍,如平衡不移动,A的浓度为0.3mol/L,实际A的浓度变为0.2mol/L,说明平衡向消耗A的方向移动,即向正反应移动, HSO3-既能电离也能水解,
易错点
利用假设法判断平衡移动方向。
正确答案
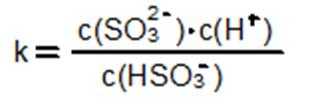
HSO3-既能电离也能水解,但其电离大于水解,显酸性.
解析
HSO3-既能电离也能水解,Ka2=6.3*10-8。Kh= 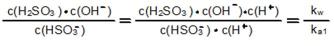
考查方向
解题思路
保持温度不变,将容器的体积扩大两倍,如平衡不移动,A的浓度为0.3mol/L,实际A的浓度变为0.2mol/L,说明平衡向消耗A的方向移动,即向正反应移动, HSO3-既能电离也能水解
易错点
利用假设法判断平衡移动方向。
正确答案
0.98gCu(OH)2即0.01mol,加热至1100
解析
产物A:CuO产物B:Cu2O有关反应:
Cu(OH)2 ==加热== CuO + H2O↑ 2.4CuO ==加热== 2Cu2O + O2↑ Cu2O + 2HCl = CuCl2 + Cu↓ + H2O,蓝色溶液是CuCl2,红色固体是Cu粉末3.3CuO + 2NH3 ==高温== 3Cu + N2↑ + 3H2O↑,红色物质是Cu,无污染气体是N2;0.98gCu(OH)2即0.01mol,加热至1100
考查方向
解题思路
产物A:CuO产物B:Cu2O有关反应:
Cu(OH)2 ==加热== CuO + H2O↑4CuO ==加热== 2Cu2O + O2↑ Cu2O + 2HCl = CuCl2 + Cu↓ + H2O,蓝色溶液是CuCl2,红色固体是Cu粉末3CuO + 2NH3 ==高温== 3Cu + N2↑ + 3H2O↑, 0.98gCu(OH)2即0.01mol,加热至1100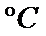
易错点
利用假设法判断平衡移动方向。
正确答案
3CuO+2NH3
解析
3CuO+2NH3
考查方向
解题思路
3CuO+2NH3

易错点
利用假设法判断平衡移动方向。
正确答案
Cu2O+2H+
解析
Cu2O+2H+
考查方向
解题思路
3CuO+2NH3

易错点
利用假设法判断平衡移动方向。
硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应方程式如下 :Na2SO4+4C → Na2S+ 4CO Na2SO4+4CO → Na2S+ 4CO2
50.现有无水芒硝17.75 g,若生成过程中无水芒硝的利用率为80%,则理论上可得到 Na2S___________g,最多生成标况下的CO _________L。
51.若在反应过程中生成的Na2S 3mol,则消耗的碳单质的物质的量 n的范围是______mol≤n≤_____mol,若生成等物质的量CO和CO2,则消耗的碳的物质的量为________mol。
52.Na2S放置在空气中,会被缓慢氧化成Na2SO4 及 Na2SO3 ,现称取已经部分氧化的硫化
钠样品78.40g 溶于水中,加入足量盐酸,充分反应后过滤得沉淀19.20g,放出H2S气体2.24L (标准状况)。请计算:78.40g样品中各氧化产物的物质的量(写出必要的计算过程)。
正确答案
7.8g 8.96L
解析
无水芒硝17.75g的物质的量=
考查方向
化学计算
解题思路
根据
计算无水芒硝的物质的量,根据硫元素守恒计算得到Na2S的物质的量,再根据m=nM计算Na2S的质量
易错点
注意S元素的守恒
教师点评
本题主要考查化学计算,题目较简单
正确答案
6mol≤n≤12mol ( 2分) 8 (2分)
解析
若生成的气体为CO,消耗的碳的物质的量最多,由Na2SO4+4C
若生成等物质的量CO和CO2,令各自物质的量为ymol,根据电子注意守恒,则2y+4y=3×[6-(-2)],解得y=4,根据碳原子守恒可知,需要碳的物质的量为4mol+4mol=8mol
考查方向
化学计算
解题思路
若生成的气体为CO,消耗的碳的物质的量最多,若生成的气体为CO2,消耗的碳的物质的量最少;若产生的气体最终只有CO2,反应中C元素化合价由0价升高为+4价,根据电子转移守恒计算需要碳的物质的量;
若生成等物质的量CO和CO2,根据电子转移守恒计算CO和CO2的物质的量,再根据碳原子守恒计算碳的物质的量
易错点
依据电子守恒进行计算
教师点评
主要考查化学计算,题目较简单
正确答案
Na2SO3有0.2mol, Na2SO4 0.1mol
解析
19.2g为硫的物质的量是0.6mol,由方程式:2Na2S+Na2SO3+6HCl=NaCl+3S↓+3H2O可知,参加该反应的Na2S为0.4mol,Na2SO3的物质的量为0.2mol,2.24LH2S气体的物质的量为0.1mol,根据反应2HCl+Na2S=2NaCl+H2S↑可知,参加该反应的Na2S的物质的量为0.1mol,故样品中Na2SO4的质量为78.40g-0.2mol×126g/mol-(0.4mol+0.1mol)×78g/mol=14.2g,故Na2SO4的物质的量为0.1mol,
故78.40g样品中氧化产物:Na2SO3为0.2mol,Na2SO4为0.1mol
考查方向
s元素的守恒
解题思路
Na2S与Na2SO3在酸性条件下发生反应:2Na2S+Na2SO3+6HCl=NaCl+3S↓+3H2O,故19.2g为硫的质量,放出H2S气体2.24L,还发生反应2HCl+Na2S=2NaCl+H2S↑,根据


教师点评
本题考查混合物的有关计算,注意利用极限法与守恒法进行的计算,是对学生综合能力的考查,难度中等
5.10 mL浓度为1 mol·L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能加快反应
速率但又不影响氢气生成量的是
正确答案
解析
A.加入K2SO4溶液,相当于加水稀释,溶液中氢离子浓度降低,故能减慢反应速率,故A错误;
B,加入CH3COONa溶液,溶液被稀释,且醋酸根与溶液中氢离子结合为醋酸分子,溶液中氢离子浓度降低,故能减慢反应速率,故B错误;
C.Zn可以置换出Cu,构成原电池,加快反应速率,且氢离子总量不变,故能加快反应速率且又不影响氢气生成量,故C正确;
D.加入碳酸钠溶液,与盐酸反应是二氧化碳,氢离子总量较小,生成氢气的量减少,故D错误,
考查方向
化学反应速率的影响因素
解题思路
过量锌与一定量的盐酸反应,为了加快反应速率,可以升高温度、增大锌固体的表面积或形成原电池反应,不影响生成氢气的总量,所加入物质不能改变氢离子的总物质的量,以此解答该题
易错点
C选项构成原电池,加快反应速率
教师点评
本题考查化学反应速率影响因素,比较基础,需注意生成氢气的量不变
知识点
5.下列说法正确的是()
正确答案
解析
A.氢氧化钠溶液和氨水具有相同的pH,由于氢氧化钠是强电解质,则在稀释时强碱的变化程度大,加水稀释促进一水合氨电离;
B. 常温下5.0×10-3mol·L-1KHA溶液的pH=3.75 ,说明HA-是弱离子,电离大于水解,该溶液中c(A2-)>c(H2A) C. HCN是很弱的酸,因此假设刚好中和 全部生成 NaCN,由于CN-会水解,必定造成CN-的浓度小于Na+的浓度,因此a=b时 也是c(Na+)>c(CN-)D. Na2C2O4溶液:存在物料守恒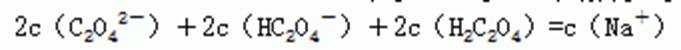
考查方向
解题思路
A.氢氧化钠是强电解质,则在稀释时强碱的变化程度大;
B. HA-是弱离子,存在电离和水解 ;
C. HCN生成NaCN,由于CN-会水解;
D. Na2C2O4溶液:存在物料守恒和电荷守恒二式。
易错点
本题属于综合知识的考查,易错点注意盐的类型和溶液酸碱性关系,酸碱都抑制水的电离.
知识点
11.常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列说法中正确的是
正确答案
解析
A.该现象说明了NaHCO3溶解度相对与氯化铵等物质较小,NaHCO3可溶于水,A错误;
B.溶液中存在物料守恒,即:c(Na)=c(C),则:c(Na+)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3),HCO3-水解程度大于电离程度,因此滤液中的c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-),B错误;
C.根据电荷守恒,滤液中c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-),C错误;
D.滤液中剩余的溶质主要是少量碳酸氢铵和氯化铵,铵根离子水解,浓度小于氯离子,但水解程度较小,仍然大于碳酸氢根离子,铵根离子水解大于碳酸氢根离子水解,溶液显酸性,因此c(Cl-)>c(NH4+)>c(HCO3-)>c(H+)>c(OH-),D正确;
故选D。
考查方向
解题思路
A.该现象说明了NaHCO3溶解度相对与氯化铵等物质较小;
B.溶液中存在物料守恒,即:c(Na)=c(C),则:c(Na+)=c(HCO3﹣)+c(CO32﹣)+c(H2CO3),HCO3-水解程度大于电离程度;
C.根据电荷守恒,滤液中c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-);
D.滤液中剩余的溶质主要是少量碳酸氢铵和氯化铵,铵根离子水解,浓度小于氯离子,但水解程度较小,仍然大于碳酸氢根离子,铵根离子水解大于碳酸氢根离子水解,溶液显酸性;
易错点
本题考查离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒即盐的水解原理的含义为解答关键,注意熟练掌握判断离子浓度大小常用方法,试题培养了学生灵活应用基础知识的能力。
知识点
现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物。甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量。
甲组同学取了数分相同质量的样品A溶于水,然后分别加入不同体积的1mol/L的NaOH溶液,水浴加热至气体全部逸出。(此温度下,铵盐不分解)。该气体干燥后用足量的浓硫酸完全吸收。浓硫酸增重的质量与加入NaOH溶液的体积的关系如右图。分析该图像,并回答下列问题:
(1)写出ab段涉及的离子方程式: 。
(2)c点对应的数值是 ;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为 。
乙组同学取了数份不同质量的样品B,分别加入到200mL 1mol/L的NaOH溶液中,同样用水浴加热,将逸出气体干燥后再用浓H2SO4吸收。测定结果如下表:
分析该表,并回答下列问题:
(3)①分析实验数据可知,实验编号为 的实验中,氢氧化钠足量,铵盐中的铵根离子完全转化成气体;m的值为 。
②计算样品B中氮元素的质量分数。(用小数表示,保留两位小数)
(4)乙组同学在研究时发现,浓硫酸增重的质量与样品B的质量之间满足一定的函数关系。假设样品的质量为x(g),浓硫酸增重的质量为y(g)。求:当x在不同
正确答案
(1)NH4+ + OH― 
(2)4.25 9:2
(3)①Ⅰ 2.04 ②0.17
(4)
解析
略
知识点
硫化钠是由无水硫酸钠与炭粉在高温下反应制得。反应的化学方程式如下:
① Na2SO4+ 4C→ Na2S+ 4CO↑ ② Na2SO4+ 4CO→ Na2S+ 4CO2↑
(1)要制取Na2S 15.6 g,需原料芒硝(Na2SO4·10H2O)_____________mol。
(2)制得的Na2S固体中含少量Na2SO4、碳粉等杂质。称取该固体0.200 g,加适量水溶解后加入25.0 mL 0.100 mol/L的I2标准液,待反应完全后用0.100 mol/L Na2S2O3溶液滴定,消耗Na2S2O3溶液16.0 mL(已知:滴定时 Na2S2O3转化为Na2S4O6),则该Na2S的纯度为__________。
(3)① 若在反应过程中,产生CO和CO2混合气体的体积为44.8L(标准状况),生成Na2S的物质的量(n mol)的范围是__________< n < ___________;
② 若在上述过程中生成Na2S的质量为62.4 g,则混合气体中CO和CO2的体积比是多少?
(4)硫化钠晶体(Na2S·9H2O)放置在空气中,会缓慢氧化成Na2SO3·7H2O和Na2SO4·10H2O。现称取在空气中已部分氧化的硫化钠晶体25.76 g溶于水,加入足量用盐酸酸化的BaCl2溶液,过滤得沉淀5.62 g,放出H2S气体1.12 L(标准状况),求原硫化钠晶体的质量。
正确答案
(1)0.2
(2) 66.3%
(3)①0.5 1.0 ② 2:3
(4)24g
解析
略
知识点
已知H2S 有可燃烧性,燃烧时氧气的量不同,产物也不同。
(1)在标准状况下,H2S和O2 的混合气体120mL,经点燃后,反应至完全,所得气体经干燥后,恢复到原来状况,体积为15mL,该15mL气体可能是( )
A,H2S和SO2 B,O2 C,H2S D,SO2和O2
(2)、若标准状况下,上述气体,H2S和O2 的混合气体120mL,经点燃后,反应至完全,所得气体经干燥后,恢复到原来状况,体积为30mL,求原气体可能的组成。
(3)已知硫化氢气体在空气中的体积分数为4.3%~45.5%时点燃会发生爆炸,当硫化氢在空气中的体积分数为20%时,其爆炸产物是 。
(4)在标准状况下,将120mL H2S和O2的混合气体点燃,若原混合气体中H2S 为x mL,反应后所得气体的总体积为y mL,求:
①当x在不同范围时y与x的函数关系。
②当y=60mL时,原H2S 的体积可能是多少。
正确答案
(1)C
(2)①H2S:90mL O2:30mL ② H2S:60 mL O2:60mL
(3)S、SO2、H2O
(4)①120>x≥80 y=3x-240 0<x≤80 y=120-1.5x
②100mL 40mL
解析
略
知识点
10.氟化氢气体能以(HF)n形式存在,已知氟化氢气体中存在下面的平衡:
则下列叙述中,不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析