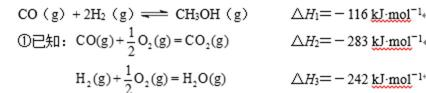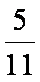- 化学平衡的计算
- 共48题
硼酸(H3BO3)在食品、医药领域应用广泛。
(1)请完成B2H6气体与水反应的化学方程式:B2H6 + 6H2O=2H3BO3 +________。
(2)在其他条件相同时,反应H3BO3 +3CH3OHB(OCH3)3 +3H2O中,H3BO 3的转化率(
① 温度对应该反应的反应速率和平衡移动的影响是_______.
② 该反应的
(3)H3BO 3溶液中存在如下反应:
H3BO 3(aq)+H2O(l)=[B(OH)4]-( aq)+H+(aq).已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,c平衡(H+)=2. 0 × 10-5mol·L-1,c平衡(H3BO 3)
正确答案
(1)B2H6 + 6H2O=2H3BO3 +6H2
(2) ①升高温度,反应速率加快,平衡正向移动
② >
(3)解依题意 H3BO 3(aq)+H2O(l)= [B(OH)4]-( aq)+H+(aq)
解析
略
知识点
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料。羰基法提纯粗镍涉及的两步反应依次为:
①Ni(S)+4CO(g)

完成下列填空:
(1)在温度不变的情况下,要提高反应(1)中Ni(CO4)的产率,可采取的措施有 、 。
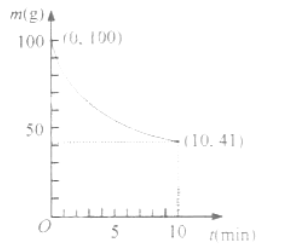
(2)已知在一定条件下的2L密闭容器中制备Ni(CO)4,粗镍(纯度98.5%,所含杂质不与CO反应)剩余质量和反应时间的关系如下图所示。Ni(CO)4在0~10min的平均反应速率为 。
(3)若反应(2)达到平衡后,保持其他条件不变,降低温度,重新达到平衡时 。
A.平衡常数K增大
B.CO的浓度减小
C.Ni的质量减小
D.v逆[Ni(CO)4]增大
(4)简述羰基法提纯粗镍的操作过程。
正确答案
(1)增大CO浓度,加压。
(2)0.05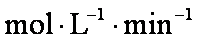
(3)bc。
(4)把粗镍和CO放于一个水平放置的密闭的玻璃容器中,然后在低温下反应,一段时间后在容器的一端加热。
解析
(1)反应(1)是正向气体体积缩小的放热反应,因此,根据平衡移动原理在温度不变的情况下采取可增大CO浓度,加压的方法提高产率;
(2)根据题意,反应的Ni为1mol,则生成

(3)反应(2)正向气体体积增大的吸热反应,降低温度平衡逆向移动,平衡常数K、CO的浓度、Ni的质量、v逆[
(4)根据反应①②的特点可提纯粗镍。
知识点
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量CO2)直接制备二甲醚,其中主要过程包括下列四个反应:
甲醇合成反应:
(i)CO(g)+2H2(g)=CH3OH(g) △H1=-90.1 kJ/mol
(ii)CO2(g)+3H2(g)=CH3OH(g)+H2O △H2=-40.9 kJ/mol
水煤气变换反应:
(iii)CO(g)+H2O(g)= CO2(g)+H2(g) △H3=-41.1 kJ/mol
二甲醚合成反应:
(iv)2CH3OH(g)= CH3OCH3(g)+H2O △H4=-24.5 kJ/mol
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂主要成分之一。工业上从铝土矿制备高纯Al2O的主要工艺流程是 。(用化学方程式表示)
(2)分析二甲醚合成反应(iv)对CO转化率的影响 。
(3)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。根据化学反应原理,增加压强对直接制备二甲醚的反应的影响 。
(4)有研究者在催化剂(含Cu-Zn-Al-O、Al2O3)、压强在5.0Mpa条件下,由H2和CO直接制备二甲醚,结果如图所示。其中CO转化率随温度升高而降低的原因是 。
(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93 kW·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为 。一个二甲醚分子经过电化学氧化,可以产生 个电子的电量:该电池理论输出电压为1.20V,能量密度E= (列式计算,能量密度=电池输出电能/燃料质量)。
正确答案
(1)Al2O3+2NaOH+3H2O=2NaAl(OH)4
NaAl(OH)4+CO2=Al(OH)3+NaHCO3、2 Al(OH)3
(2)消耗甲醇,促进甲醇合成反应(i)平衡向右移,CO转化率增大:生成的水通过水煤气变换反应(iii)消耗部分CO。
(3)2CO(g)+4H2(g)=CH3OCH3(g)+H2O △H=-204.7 kJ/mol;该反应分子数减小,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加,压强升高使CO和H2浓度增大,反应速率加快。
(4)反应放热,温度升高,平衡左移。
(5)CH3OCH3+3H2O=2CO2+12H++12e-;12;
解析
略
知识点
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
____C+____K2Cr2O7 + ====___CO2↑+ ____K2SO4 + ____Cr2(SO4)3+ ____H2O
请完成并配平上述化学方程式。
其中氧化剂是________________,氧化产物是_________________
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程为 ;
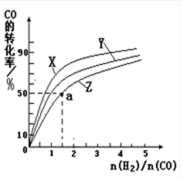
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) 
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
若5min~10min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是 。
正确答案
(1)3 2 8 H2SO4 3 2 2 8 (3分,填上H2SO41分,配平2分)
K2Cr2O7(1分),CO2(1分)
(2)①CH3OH(g)+3/2O2(g)= CO2(g)+ 2H2O(g) △H=-651kJ·mol-1(3分)
②ⅰ)270℃(2分) ⅱ) 4 L2 /mol2(2分,没单位不扣分)
③增大H2的浓度(2分);增大了0.1 mol•L-1(2分)
解析
略
知识点
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷.氧气和水蒸气,发生的主要化学反应有:
回答下列问题:
(1)反应CO(g)+H2O(g)
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于.小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以平衡常数(记作KP),则反应CH4(g)+H2O(g)
随着温度的升高,该平衡常数 (填“增大”.“减小”或“不变”)。
(4)从能量阶段分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度.压强对H2和CO物质的量分数的影响如下图:
①若要达到H2物质的量分数>65%.CO的物质的量分数<10%,以下条件中最合适的是 。
(a)600℃,0.9Mpa
(b)700℃,0.9MPa
(c)800℃,1.5Mpa
(d)1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)
的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
正确答案
见解析。
解析
(1)根据盖斯定律,由蒸汽重整的两个反应不难得出该反应的△H=-41.2kJ/mol
(2)由于甲烷氧化的活化能低于蒸汽重整的活化能,所以蒸汽重整速率小于甲烷氧化速率。
(3)Kp=
(4)由于放热的甲烷氧化产生的热量可以供给吸热的蒸汽重整,提高了能源的利用率。
(5)简单读图,条件B同时符合“H2物质的量分数>65%.CO的物质的量分数<10%”;
作图的关键是找准零时刻起点位置,反应过程中的变化趋势以及平衡以后的终点位置,氢气不是原料气,即开始时刻氢气含量为0,由图中可以读出600℃,0.1Mpa条件下,平衡系统中H2物质的量分数为70%,因此不难作图如下:
(6)甲烷氧化程度过高,氢气会和氧气反应。
知识点
在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
反应时间(t)与容器内气体总压强(p)的数据见下表:
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为 。
(2)由总压强P和起始压强P0计算反应物A的转化率α(A)的表达式为 。
平衡时A的转化率为_ ,列式并计算反应的平衡常数K 。
(3)①由总压强p和起始压强p0表示反应体系的总物质的量n总和反应物A的物质的量n(A),n总= mol,n(A)= mol。
②下表为反应物A浓度与反应时间的数据,计算a=
正确答案
答案:
(1)升高温度、降低压强
(2)
(3)
②0.051;每间隔4小时,A的浓度为原来的一半。0.013
解析
(1)根据反应是放热反应特征和是气体分子数增大的特征,要使A的转化率增大,平衡要正向移动,可以采用升高温度、降低压强的方法。
(2)反应前气体总物质的量为0.10mol,令A的转化率为α(A),改变量为0.10α(A) mol,根据差量法,气体增加0.10α(A)mol,由阿伏加德罗定律列出关系:
平衡浓度C(C)=C(B)=0.1×94.1%=0.0941mol/L,C(A)=0.1-0.0941=0.0059mol/L,
(3)

每间隔4小时,A的浓度为原来的一半。
当反应12小时时,C(A)=0.026/2=0.013mol/L
知识点
在容积可变的密闭容器中,2mol


正确答案
解析
依据三行式,平衡时N2、H2、NH3,的物质的量分别为4/3、6、4/3, N2的物质的量分数约等于15%,故氮气的体积分数接近于15%,故答案选C。
知识点
反应aA(g)+bB(g)

回答问题:
(1)反应的化学方程式中,a:b:c为________;
(2)A的平均反应速率


(3)B的平衡转化率
(4)由第一次平衡到第二次平衡,平衡移动的方向是________,采取的措施是________;
(5)比较第II阶段反应温度(



(6)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C)。
正确答案
见解析。
解析
图像题的解答要看清图像的横、纵坐标所代表的意义,曲线的走势,然后结合原理分析作答。
(1)依据图示A、B、C三种物质的物质的量的变化分别为1mol、3 mol、2 mol,故a∶b∶c=1∶3∶2。
(2)vⅠ(A)=(2.0-1.00)mol·L-1/20.0min=0.05 mol·L-1·min-1、vⅡ(A)=(1.00-0.62)/15.0 min=0.025 mol·L-1·min-1、vⅢ(A)=( 0.62-0.50) mol·L-1/10 min=0.012 mol·L-1·min-1。故:vⅠ(A) >vⅡ(A) >vⅢ(A)。
(3)由图可知αⅠ(B)=0.5、αⅡ(B)=1.14/3.00=0.38、αⅢ(B)=0.36/1.86=0.19,则B的平衡转化率最小的是αⅢ(B),其值为0.19。
(4)第一次平衡后A、B的浓度从平衡点开始降低,而C的物质的量浓度突然变为0,则平衡向右移动,此时采取的措施是将C从平衡混合物中液化分离出去。
(5)因为该反应为放热反应,故T2<T3。
(6)第Ⅳ阶段体系中各物质的浓度随时间变化的趋势如下图所示:
知识点
可逆反应①X(g)+2Y(g )
下列判断正确的是( )
正确答案
解析
降温由平衡(I)向平衡(II)移动,同时X、Y、Z的物质的量减少,说明平衡向右移动,正反应放热,A项错误。达平衡(I)时的压强于开始时的体系的压强之比为:2.8:3=14:15,B项正确。达平衡(I)时,反应①的总物质的量由3.0 mol减小为2.8 mol,设反应的X的物质的量为△n(X),利用差量可得:1:1=△n(X):(3.0-2.8),解之得:△n(X)=0.2 mol,则X的转化率为:×100%=20%,C项错误。由平衡(I)到平衡(II),化学反应②发生移动,M的体积分数不会相等的,D项错误。
知识点
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)
下列说法正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析