- 化学反应速率与化学平衡图象的综合应用
- 共80题
容积均为1L的甲、乙两个恒容容器中,分别充入2molA、2molB和1molA、1molB,相同条件下,发生下列反应:A(g)+B(g)
正确答案
解析
略。
知识点
10.工业上“固定”和利用CO2能有效地减轻“温室’效应。有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g) 
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是()
A. n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
D.容器内的密度保持不变
(2)一定温度时将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6 mol。
① a点正反应速率________逆反应速率(填“大于”、“等于”或“小于”)。
② 仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验条件改变是_________,曲线Ⅱ对应的实验条件改变是________。
③ 在题给图中绘出加入催化剂对应的曲线。
④ 结合图给实线的数据,计算该温度时反应的化学平衡常数。(写出计算过程)
(3)甲醇可用以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为: ___________ 。
正确答案
(1) BC
(2)
① 大于
② 升高温度 增大压强
③
④
K = c(CH3OH)×c(H2O)/ c(CO2)×c3(H2)
=1 (mol / L ) ·1 (mol / L )/ 13 (mol / L )· 2(mol / L )=0.5L-2 / mol-2
(3)CH3OH+8OH--6e-=CO32-+ 6H2O
解析
略
知识点
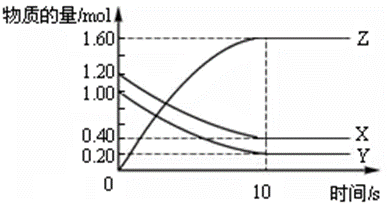
在恒温条件下,将气体X、Y充入2 L密闭容器中反应生成气体Z。若各气体的物质的量随时间变化曲线如右图所示,下列描述正确的是( )。
正确答案
解析
略
知识点
密闭容器中充有10 mol CO与20 mol H2,在催化剂作用下反应生成甲醇:
O(g)+2H2(g) 
下列说法正确的是
正确答案
解析
略
知识点
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应:
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+


C(s)+ O2(g)==CO2(g) 

S(s)+O2(g)==SO2(g) 

则SO2(g)+2CO(g)==S(s)+2CO2(g) 
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图28(3)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时
700oC时,其中最难被还原的金属氧化物是________(填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于________。
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图28(4)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为________。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为________L。
正确答案
(1)C
(2)-(2Q2-2Q1-Q3) kJ·mol-1或(2Q1-2Q2+Q3)kJ·mol-1
(3)Cr2O3;10-12
(4)NO2+NO3--e-=N2O5;224
解析
略。
知识点
PCl3和PCl5都是重要的化工原料。将PCl3(g) 和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,并于10 min时达到平衡:PCl3(g) + Cl2(g) 
有关数据如下:
下列判断不正确的是
正确答案
解析
略
知识点
T ℃时在2 L的密闭容器中X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图甲所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图乙所示。
则下列结论正确的是
正确答案
解析
略
知识点
难溶性杂卤石(K2SO4•MgSO4•2CaSO4•2H2O)属于“呆矿”,在水中存在如下平衡
K2SO4•MgSO4•2CaSO4•2H2O (s)
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
(1)滤渣主要成分有_________和_________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出、K+的原因:__________________。
(3)“除杂”环节中,先加入_________溶液,经搅拌等操作后,过滤,再加入_________溶液调滤液pH至中性。
(4)过滤得到的母液中含有大量的_________(填写化学式),溶液中离子浓度大小顺序为__________________,检验其中溶质阴离子的方法是___________________________。
(5)不同温度下,K+的浸出浓度与溶浸时间的关系如右图,由图可得,随着温度升高
①______________________________________________________
②______________________________________________________
正确答案
(1)CaSO4 Mg(OH)2
(2)氢氧根离子与镁离子结合,使平衡向右移动,K+变多
(3)K2CO3 H2SO4
(4)K2SO4 c(K+)>c(SO42-)>c(H+)=c(OH-)
(5)①在同一时间K+的浸出浓度大。
②反应的速率加快,平衡时溶浸时间短
解析
略
知识点
N2(g)+3H2(g)
正确答案
解析
略。
知识点
28.工业上“固定”和利用CO2能有效地减轻“温室’效应。有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g) 
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是_________。
A. n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
D.容器内的密度保持不变
(2)一定温度时将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6 mol。
① a点正反应速率_________逆反应速率(填“大于”、“等于”或“小于”)。
② 仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验条件改变是_________,曲线Ⅱ对应的实验条件改变是_________ 。
③ 在题给图中绘出加入催化剂对应的曲线。
④ 结合图给实线的数据,计算该温度时反应的化学平衡常数。(写出计算过程)
(3)甲醇可用以制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:_________ 。
正确答案
见解析。
解析
(1) BC
(2) ① 大于;
② 升高温度 ;增大压强
③
④
(3)CH3OH+8OH--6e-=CO32-+ 6H2O
知识点
扫码查看完整答案与解析