- 化学反应速率与化学平衡图象的综合应用
- 共80题
化合物


(1)已知




(2)反应


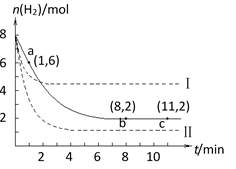
①列式计算实验a从反应开始至达到平衡时的反应速率 v(
②图中3组实验从反应开始至达到平衡时的反应速率v(
③用

正确答案
(1)
(2)①
②bca;加入催化剂。反应速率加快,但平衡点没有改变;温度升高。反应速率加快,但平衡点向逆反应方向移动(或反应容器的溶剂和起始物质的量未改变,但起始总压强增大)
③
解析
略。
知识点
在密闭容器中发生反应:X+3Y
正确答案
解析
略
知识点
T ℃时,将6 mol CO2和8 mol H2充入2 L密闭容器中,发生反应CO2(g)+3H2(g) 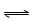
正确答案
解析
略
知识点
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)
回答下列问题:
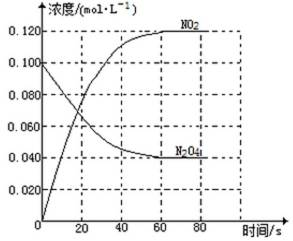
(1)反应的△H 0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为 mol·L-1·s-1反应的平衡常数K1为 。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。
①T 100℃(填“大于”“小于”),判断理由是 。
②列式计算温度T是反应的平衡常数K2
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向 (填“正反应”或“逆反应”)方向移动,判断理由是 。
正确答案
(1)① 大于 ② 0.0010 ③0.36mol·L-1
(2)a:④大于
⑤ 反应正方向吸热,反应向吸热方向进行,故温度升高
b:⑥平衡时,c(NO2)= 0.120mol·L-1 +0.0020mol·L-1·S-2×10s×2=0.16mol·L-1
c(N2O4)=0.040 mol·L-1-0.0020 mol·L-4×10s=0.020 mol·L-1
K2= 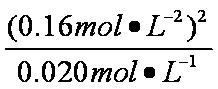
(3)逆反应 对气体分子数增大的反应,增大压强平衡向逆反应方向移动
解析
略
知识点
工业上采用乙苯与
其中乙苯在
(1)上述乙苯与

(2)①乙苯与
②下列叙述不能说明乙苯与
a。
c,消耗


(3)在3L密闭容器内,乙苯与




别改变了实验其他条件;乙苯的浓度随时间的变化如图I所示。
①实验I乙苯在0-50min时的反应速率为_______________
②实验Ⅱ可能改变条件的是__________________________
③图II是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线。
(4)若实验I中将乙苯的起始浓度改为
正确答案
(1)
(2)
(每空2分 共4分)
(3)①
②加入催化剂
③
(4)减小(2分);0.225 (2分)
解析
略
知识点
扫码查看完整答案与解析