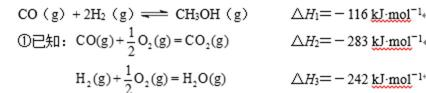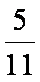- 化学平衡的计算
- 共48题
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
____C+____K2Cr2O7 + ====___CO2↑+ ____K2SO4 + ____Cr2(SO4)3+ ____H2O
请完成并配平上述化学方程式。
其中氧化剂是________________,氧化产物是_________________
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程为 ;
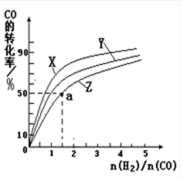
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) 
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol•L-1)变化如下表所示:
若5min~10min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是 。
正确答案
(1)3 2 8 H2SO4 3 2 2 8 (3分,填上H2SO41分,配平2分)
K2Cr2O7(1分),CO2(1分)
(2)①CH3OH(g)+3/2O2(g)= CO2(g)+ 2H2O(g) △H=-651kJ·mol-1(3分)
②ⅰ)270℃(2分) ⅱ) 4 L2 /mol2(2分,没单位不扣分)
③增大H2的浓度(2分);增大了0.1 mol•L-1(2分)
解析
略
知识点
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷.氧气和水蒸气,发生的主要化学反应有:
回答下列问题:
(1)反应CO(g)+H2O(g)
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于.小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以平衡常数(记作KP),则反应CH4(g)+H2O(g)
随着温度的升高,该平衡常数 (填“增大”.“减小”或“不变”)。
(4)从能量阶段分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度.压强对H2和CO物质的量分数的影响如下图:
①若要达到H2物质的量分数>65%.CO的物质的量分数<10%,以下条件中最合适的是 。
(a)600℃,0.9Mpa
(b)700℃,0.9MPa
(c)800℃,1.5Mpa
(d)1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)
的变化趋势示意图:
(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
正确答案
见解析。
解析
(1)根据盖斯定律,由蒸汽重整的两个反应不难得出该反应的△H=-41.2kJ/mol
(2)由于甲烷氧化的活化能低于蒸汽重整的活化能,所以蒸汽重整速率小于甲烷氧化速率。
(3)Kp=
(4)由于放热的甲烷氧化产生的热量可以供给吸热的蒸汽重整,提高了能源的利用率。
(5)简单读图,条件B同时符合“H2物质的量分数>65%.CO的物质的量分数<10%”;
作图的关键是找准零时刻起点位置,反应过程中的变化趋势以及平衡以后的终点位置,氢气不是原料气,即开始时刻氢气含量为0,由图中可以读出600℃,0.1Mpa条件下,平衡系统中H2物质的量分数为70%,因此不难作图如下:
(6)甲烷氧化程度过高,氢气会和氧气反应。
知识点
在容积可变的密闭容器中,2mol


正确答案
解析
依据三行式,平衡时N2、H2、NH3,的物质的量分别为4/3、6、4/3, N2的物质的量分数约等于15%,故氮气的体积分数接近于15%,故答案选C。
知识点
反应aA(g)+bB(g)

回答问题:
(1)反应的化学方程式中,a:b:c为________;
(2)A的平均反应速率


(3)B的平衡转化率
(4)由第一次平衡到第二次平衡,平衡移动的方向是________,采取的措施是________;
(5)比较第II阶段反应温度(



(6)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C)。
正确答案
见解析。
解析
图像题的解答要看清图像的横、纵坐标所代表的意义,曲线的走势,然后结合原理分析作答。
(1)依据图示A、B、C三种物质的物质的量的变化分别为1mol、3 mol、2 mol,故a∶b∶c=1∶3∶2。
(2)vⅠ(A)=(2.0-1.00)mol·L-1/20.0min=0.05 mol·L-1·min-1、vⅡ(A)=(1.00-0.62)/15.0 min=0.025 mol·L-1·min-1、vⅢ(A)=( 0.62-0.50) mol·L-1/10 min=0.012 mol·L-1·min-1。故:vⅠ(A) >vⅡ(A) >vⅢ(A)。
(3)由图可知αⅠ(B)=0.5、αⅡ(B)=1.14/3.00=0.38、αⅢ(B)=0.36/1.86=0.19,则B的平衡转化率最小的是αⅢ(B),其值为0.19。
(4)第一次平衡后A、B的浓度从平衡点开始降低,而C的物质的量浓度突然变为0,则平衡向右移动,此时采取的措施是将C从平衡混合物中液化分离出去。
(5)因为该反应为放热反应,故T2<T3。
(6)第Ⅳ阶段体系中各物质的浓度随时间变化的趋势如下图所示:
知识点
可逆反应①X(g)+2Y(g )
下列判断正确的是( )
正确答案
解析
降温由平衡(I)向平衡(II)移动,同时X、Y、Z的物质的量减少,说明平衡向右移动,正反应放热,A项错误。达平衡(I)时的压强于开始时的体系的压强之比为:2.8:3=14:15,B项正确。达平衡(I)时,反应①的总物质的量由3.0 mol减小为2.8 mol,设反应的X的物质的量为△n(X),利用差量可得:1:1=△n(X):(3.0-2.8),解之得:△n(X)=0.2 mol,则X的转化率为:×100%=20%,C项错误。由平衡(I)到平衡(II),化学反应②发生移动,M的体积分数不会相等的,D项错误。
知识点
扫码查看完整答案与解析