- 化学反应速率与化学平衡图象的综合应用
- 共80题
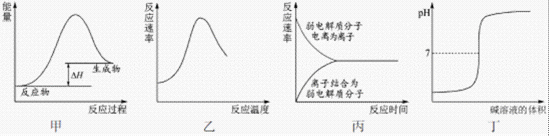
10.下列图示与对应的叙述不相符合的是
正确答案
解析
燃料燃烧反应是放热反应,生成物的总能量低于反应物总能量,A错误;酶是蛋白质,其催化作用随温度升高增强,但过高时,易引起变性或其催化作用减小,B是正确的;弱电解质加入水时,电离速率较大,而后逐渐减小,生成的离子结合成分子的速率逐渐增大,最后二者相等达到平衡,C图像正确;强酸强碱盐的滴定,溶液的PH逐渐增大,快要达到终点时,发生突跃,D图像正确;正确选项为A。
考查方向
解题思路
图像题一看面:纵坐标和横坐标,二看线:走势,三看特殊点:起点和拐点。
易错点
酶的催化效率与温度的关系,温度太高或太低都不利于酶的催化。
知识点
28.开发新能源、新材料是实现社会可持续发展的需要。请回答下列问题:
(1)下图是2LiBH4/MgH2体系放氢焓变示意图。
则:Mg(s)+2B(s)=MgB2(s) ΔH= 。
(2)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:25℃水浴时,每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系如图所示。下列说法正确的是 (填字母)。
A.25℃时,纯铝与水不反应
B.25℃时,纯LiBH4与水反应产生氢气
C.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
(3)工业上可采用CO和H2合成再生能源甲醇,其反应的化学方程式为CO(g)+2H2(g)
①在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示。
则:上述合成甲醇的反应为 反应(填“放热”或“吸热”)。平衡常数KA、KB、KC的大小关系为 。若达到平衡状态A时容器的体积为10 L,则平衡状态B时容器的体积为 L。
②图中虚线为该反应在使用催化剂条件下,起始H2、CO投料比和CO平衡转化率的关系图。
当其他条件完全相同时,用实线画出不使用催化剂情况下,起始H2、CO投料比和CO平衡转化率的关系示意图。
(4)次磷酸钴广泛应用于化学镀钴,工业上利用电解法制备次磷酸钴的电极材料为金属钴和不锈钢,其电解装置如图所示(其中阴离子交换膜只允许阴离子通过,其中阳离子交换膜只允许阳离子通过)。
则:①N极的电极反应式为: ;
②次磷酸钴在 区生成(填“Ⅰ、Ⅱ或Ⅲ”)
③已知次磷酸与足量氢氧化钠溶液反应的化学方程式为:H3PO2 + NaOH = NaH2PO2 + H2O,则NaH2PO2溶液中离子浓度由大到小的顺序为 。
正确答案
(1)-93KJ/mol
(2)AB
(3)
①放热 KA=KB>KC 2
② 如图
(4)
① 2H2O +2e- =H2 +OH- 或2H++2e- =H2
②Ⅰ
③c(Na+)>c(H2PO2-)>c(OH-)>c(H+)
解析
解析已在路上飞奔,马上就到!
知识点
26. 煤的气化过程中发生反应:CO(g)+H2O(g)
(1)该反应的热化学方程式可写为( )。
(2)两种反应物的转化率之和为( ) 。
(3)该条件下此反应的平衡常数为( )。
(4)若要在相同的温度下和相同的容器中,按下列物料配比充入,建立平衡后CO的体积百分含量与题干平衡相同,下列选项中可行的是( )。
(5)若要在相同的温度下和相同的容器中,充入下列物料建立平衡,平衡后CO2的体积分数与题干平衡的CO2的体积分数相同,但CO的体积分数与题干平衡中CO的体积分数不同的是( )
正确答案
(1)CO(g)+H2O
(2)1
(3)1
(4)ABC
(5)BC
解析
解析已在路上飞奔,马上就到!
知识点
12. 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.Ⅰ、下表是某研究性学习小组探究稀硫酸与金属锌反应的实验数据:
实验数据可发现有一个数据明显有错误,该数据是实验________(填实验序号),理由是_______________________________________________
Ⅱ、在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)
(1)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(2)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字表达);10min到15min的曲线变化的原因可能是 (填写编号)。
A. 加了催化剂
B. 缩小容器体积
C. 降低温度
D. 增加SO3的物质的量
正确答案
Ⅰ、 ③、 硫酸均过量,锌均全部反应,且锌质量一样,故反应放出热量一样,使等体积溶液温度升高值相近。
Ⅱ、
(1)15~20min和25~30 min
(2)增加了O2的量 A B
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析