- 性质实验方案的设计
- 共28题
为了测定实验室长期存放的Na2SO3固体的纯度,准确称取W g固体样品,配成250 mL溶液。设计了以下两种实验方案:小水制作
方案I:取25.00 mL上述溶液,加入过量的盐酸酸化的BaCl2溶液,过滤、洗涤和干燥沉淀,称得沉淀的质量为m1 g 。
方案Ⅱ:取25.00 mL上述溶液,加入过量的盐酸酸化的Ba(NO3)2溶液,过滤、洗涤和干燥沉淀,称重,其质量为m2 g 。
(1)配制250 mL Na2SO3溶液时,必须用到的实验仪器有:烧杯、玻棒、胶头滴管、药匙和__________________、_________________。
(2)写出Na2SO3固体氧化变质的化学方程式__________________________________。
(3)方案I加入过量的盐酸酸化的BaCl2溶液,目的是_____________________________,在过滤前,需要检验是否沉淀完全,其操作是___________________________。
(4)方案I中,若滤液浑浊,将导致测定结果____________(选填“偏高”或“偏低”)。
(5)若操作正确,则m1_____ m2(选填“>”、“<”或“=”),原因是________________。
(6)取25.00 mL上述溶液,用滴定的方法测定Na2SO3的纯度。下列试剂可作为标准溶液进行滴定的是________。
a.酸性KMnO4溶液 b.H2O2溶液 c.Br2水 d.FeCl3溶液
Na2SO3固体的纯度可表示为: _____________(注明你的表达式中所用的有关符号的含义和单位)。
正确答案
(1)电子天平;250 mL的容量瓶
(2)2Na2SO3+ O2→ 2Na2SO4。
(3)使SO32-充分转化为气体,使SO42-完全沉淀,静置,在上层清液中再滴入氯化钡溶液,观察是否继续有沉淀生成。
(4) 偏高
(5)<,方案II中盐酸提供H+,Ba(NO3)2提供NO3- 形成稀HNO3,将一部分SO32-氧化成SO42-,导致BaSO4质量增大。
(6)a,
解析
略
知识点
10.一溴乙烷在制药,杀虫剂,汽油抗震液中铅的消除剂中有着广泛的应用。工业上和实验室中都可用如下过程制备一溴乙烷。
某同学在实验室中模拟整个生产过程,查阅资料如下:
生产原理:NaBr+H2SO4=HBr↑+NaHSO4
正确答案
解析
(1)使反应平稳进行,防止乙醇、HBr大量挥发,充分蒸出一溴乙烷。
(2)SO42-,取少量水层1的溶液于试管中,加入足量稀盐酸化,再滴加少量的BaCl2溶液。
(3)
(4)67%
知识点
为探究SO2与可溶性钡盐能否反应生成白色BaSO3沉淀,甲、乙两同学用下图所示装置进行实验(夹持装置、加热装置已略,气密性已检验)
实验操作和现象:
(1) A中反应的化学方程式是 ________________ 。
(2) C中可溶性钡盐溶液X为___________ 。实验过程中,发现液体Y不能很顺利地滴下,则可如何改进: ______________- 。
(3)分析B中不溶于稀盐酸的沉淀的产生原因,甲同学认为是 __________ ,乙同学认为是白雾参与反应。
为证实各自的观点,在原实验基础上;甲同学在原有操作之前,先通N2一段时间。乙同学则在A、B间增加盛有饱和NaHSO3溶液的洗气瓶D。
甲、乙各自进行实验,B中现象分别如右表:由此得出的结论是 __________ 。
(4) 丙将甲乙两同学的方案进行联合试验,发现B中无沉淀生成,而C中产生白色沉淀,但无红棕色气体。C中反应的化学方程式是______________ 。
(5)丁同学认为丙选择的两种钡盐比较相似,于是丁在丙的基础上将B、C中的钡盐分别换成过量新制的醋酸钡溶液、Ba(AlO2)2溶液,发现B、C中均立即产生大量白色沉淀,该沉淀可溶于稀盐酸,并产生能使澄清石灰水浑浊的气体。C中沉淀为________。实验室里欲获得该沉淀,所需要的玻璃仪器是 ____________- 。
(6) 结合实验目的,根据四位同学的实验操作和实验现象,你得出的结论是_______________。
正确答案
(1)
(2)硝酸钡
将分液漏斗改为恒压漏斗(其他合理说法也给分)
(3)空气参与了反应;
空气、白雾均是产生白色沉淀的原因,其中白雾是主要原因。
(4)3SO2+ 2H2O+ 3Ba(NO3)2 + →3BaSO4↓+2NO↑+ 4H NO3
(5)BaSO3、氢氧化铝; 烧杯、漏斗、玻璃棒;
(6)SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀,SO2与可溶性钡的弱酸盐能反应生成BaSO3沉淀。
解析
略
知识点
28.已知:①Br2与Cl2一样能氧化氨气。
②镁条能在N2中燃烧生成黄绿色固体,遇水剧烈反应生成两种碱。
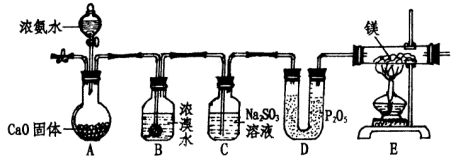
`某化学学习小组设计下列装置来制取氨气并完成相关实验。
(1)实验步骤:
①点燃E处酒精灯;
②打开A中分液漏斗活塞;
③连接装置,检查装置气密性;
④通入惰性气体,排出装置内空气;
⑤装入各仪器药品。
其操作顺序是( )。(填序号)
(2)A处固体CaO的作用是( );
(3)写出B处反应方程式 ( );
(4)C处亚硫酸钠的作用是:( )(用文字及相关离子方程式叙述);
(5)能说明反应过程有N2生成的现象是( );
(6)此装置不足之处是 ( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.已知:①


②镁条能在N2中燃烧生成黄绿色固体,该固体遇水剧烈反应生成两种碱。
某化学学习小组设计下列装置来制取氨气并完成相关实验。
(1)实验步骤:
①点燃E处酒精灯;
②打开A中分液漏斗活塞;
③连接装置,检查装置气密性;
④通入惰性气体,排出装置内空气;
⑤将药品装入各仪器装置内。
其正确的操作顺序是( )(填序号)。
(2)A处固体CaO的作用是 ( ) 。
(3)分别写出B处、E处反应的化学方程式( ), ( )。
(4)C处亚硫酸钠溶液的作用是:( )(用文字及相关离子方程式叙述);
(5)能说明反应过程中有N2生成的现象是( ) 。
(6)此装置不足之处是( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析