- 性质实验方案的设计
- 共28题
13.根据下列实验操作和现象所得到的结论正确的是
正确答案
解析
A、室温下,向苯酚钠溶液中通入足量CO2,发生反应:


考查方向
解题思路
有关实验方案的设计和对实验方案的评价是高考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便。化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力,所以,对化学实验不仅要认真观察,还应掌握观察实验现象的方法。
易错点
B项中Ksp大小的比较通过沉淀的转化或数据才能比较。
知识点
hibernation
正确答案
heavily
正确答案
25.为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用的试剂:KSCN溶液、KMnO4溶液、氯水。
(1)请完成下表:
【实验结论】Fe的氧化产物为Fe2+和Fe3+
Ⅱ.AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。
(2)装置B的作用是___________。
(3)经小组讨论并验证该无色气体为O2,其
(4)【查阅资料】Ag2O和粉末状的A

【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
【实验评价】根据上述实验,不能确定固体产物成分的实验是___________(填实验编号)。
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有___________。
正确答案
(1)
①溶液呈红色
②K2[Fe(CN)6]溶液
③产生蓝色沉淀
(2)防倒吸
(3)用带火星的木条伸入集气瓶内,木条复燃,证明无色气体为O2
(4)① b ②Ag、NO2、O2
解析
解析已在路上飞奔,马上就到!
知识点
27. 实验小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件。该小组同学为探究中毒原因进行了如下实验。
(1)小组同学依据漂白液具有漂白消毒的性质推测,漂白液中ClO-具有氧化性。实验如下:
Ⅰ. 用pH计检验,漂白液pH>7,饱和KAl(SO4)2溶液pH<7。
Ⅱ. 取10 mL漂白液,依次加入Na2SO3溶液和BaCl2溶液,有白色沉淀生成,经检验白色沉淀不溶于盐酸。
Ⅲ. 另取10 mL漂白液,加入品红溶液,溶液红色逐渐变浅,一段时间后褪为无色。
Ⅳ. 再取10 mL漂白液,加入品红溶液,加入少量稀硫酸酸化后,溶液红色立即变为无色。
①漂白液pH大于7的原因是(用离子方程式表示)__________。
②由实验Ⅱ得出ClO-具有氧化性,写出反应的离子方程式__________。
③对比实验Ⅲ和Ⅳ说明ClO-氧化性与溶液酸碱性的关系是__________。
(2)小组同学依据(1)中的实验,提出:漂白液在酸性溶液中有Cl2生成。用下图所示的装置继续实验,探究漂白液在酸性溶液中是否能反应生成Cl2。
①装置B的作用是__________;盛放的药品是__________。
②若打开分液漏斗活塞向烧瓶中加入硫酸,不久烧瓶中有黄绿色气体产生。A中反应的离子方程式为 ( )。
③若打开分液漏斗活塞向烧瓶中加入饱和KAl(SO4)2溶液,首先观察到产生大量的白色胶状沉淀,不久烧瓶中有黄绿色气体产生。A中加KAl(SO4)2溶液反应的离子方程式是( )。
(3)上述实验说明漂白液与酸性溶液混合会产生Cl2。若取10 mL漂白液与足量BaCl2溶液混合后,不断通入SO2至过量,在实验过程中可能的实验现象是( )。
正确答案
(1)
①
②
③
(2)
①吸收Cl2 NaOH溶液
②
③
(3)产生白色沉淀,溶液由无色变黄绿色,最后溶液变无色
解析
解析已在路上飞奔,马上就到!
知识点
乳酸(2-羟基丙酸)为无色液体,与水混溶,弱挥发性。它在多种生物化学过程中起作用。某学习小组研究利用发酵法制乳酸以及探讨乳酸的部分性质。
实验(一):乳酸的制取
步骤1:取14.40g葡萄糖(相对分子质量为180)于烧杯中,加入乳酸菌(厌氧)发酵,72 小时后,过滤,将滤液转移到仪器A中,定容,得到500mL原液;
步骤2:取20.00mL原液于锥形瓶中,加入酚酞作指示剂,用浓度为0.1000mol/L的NaOH
溶液滴定至终点,重复4次,数据记录如下表。(假定原液中其他物质不与NaOH
反应)
14.仪器A是 ;
15.如何判断已到达滴定终点 ;
16.乳酸的产率为____________
17. 实验(二):乳酸的性质
已知乳酸的Ka=1.4 x 10-4,碳酸的Ka1=4.47 x 10-7
设计实验证明乳酸是弱酸: ;
18.小组利用下图所示的仪器和药品,通过实验来比较乳酸与碳酸的酸性强弱。
①可观察到烧杯中的现象是 ,
写出烧杯中发生的化学反应方程式 ;
②学习小组中有成员提出上述实验设计不够严谨,请你提出改进的措施 。
正确答案
500mL容量瓶
解析
掌握配制一定物质的量浓度的溶液实验所涉及的基本仪器。
考查方向
考察基本实验仪器的使用。
解题思路
理解题意,配制500mL原液,需要500mL规格的容量瓶。
易错点
容量瓶易漏规格500mL。
教师点评
难度不大,考察基本实验及仪器,但容易漏写容量瓶的规格。
正确答案
最后一滴标准NaOH溶液滴入,锥形瓶内溶液由无色变红色,半分钟内颜色不褪色。
解析
理解题意,注意试剂的滴加顺序,准确判断滴定终点颜色变化,不要漏写半分钟颜色的变化。
考查方向
考察了酸碱中和滴定过程中的基本操作、滴定终点的判断。
解题思路
理解酸碱中和滴定的意义,掌握酸碱中和滴定的操作步骤和滴定终点的判断方法。
易错点
(1)如果不注意试剂的滴加顺序,滴定终点颜色变化会弄错;
(2)半分钟颜色不发生改变容易漏写。
教师点评
考察基本实验操作,认真阅读题意,准确答题。
正确答案
30.00%
解析
(1)首先排除第3次实验的数据,误差太大,应舍去;
(2)取三次实验的平均值,消耗19.20mL NaOH溶液;
(3)计算出n(NaOH)=1.920×10-3mol=n(乳酸)
(4)计算出原液中的乳酸总量:
n总(乳酸)=1.920×10-3×500÷20=0.04800mol
(5)计算乳酸的总质量m=0.04800mol×90g/mol=4.320g
(6)计算出乳酸的产率=4.320÷14.40×100%=30.00%
考查方向
考察滴定实验中的化学计算,要理解题意,按部就班的进行计算,需要细心。
解题思路
(1)首先排除第3次实验的数据,误差太大,应舍去;
(2)取三次实验的平均值,消耗19.20mL NaOH溶液;
(3)计算出n(NaOH)=1.920×10-3mol=n(乳酸)
(4)计算出原液中的乳酸总量:
n总(乳酸)=1.920×10-3×500÷20=0.04800mol
(5)计算乳酸的总质量m=0.04800mol×90g/mol=4.320g
(6)计算出乳酸的产率=4.320÷14.40×100%=30.00%
易错点
(1)按题意,葡萄糖的质量就是乳酸的理论质量;
(2)要注意舍去第3组滴定数据;
(3)计算乳酸的实际质量时,不要忘了原液的500mL。
教师点评
本小题有较大难度,题目设置的“坑”比较多,需要小心处理好:实验数据的有效性、计算总量要乘倍数关系等实验过程中的实际问题。
正确答案
方法1:准确配制0.1mol/L乳酸溶液,用pH计测定乳酸溶液的pH值,pH>1,证明乳酸是弱酸。
方法2:准确配制0.1mol/L乳酸钠溶液,用pH计测定乳酸钠溶液的pH值,pH>7,证明乳酸是弱酸。
方法3:准确配制0.1mol/L乳酸溶液,加入等体积的蒸馏水稀释,用pH计测定稀释后的乳酸溶液的pH值,2>pH>1,证明乳酸是弱酸。
解析
利用弱酸的不完全电离性质来进行实验论证。
考查方向
考察了弱酸的性质:不完全电离。
解题思路
理解弱酸不完全电离的本质,可以利用多种方法来证明乳酸是弱酸。
易错点
知识点掌握得不牢固,在列举方法时思维不缜密。
教师点评
本小题难度较大,需要有比较强大的基础知识,并学会理解及应用。
正确答案
①烧杯内出现浑浊(或白色沉淀);
CO2 +H2O + NaAlO2 =Al(OH)3↓ + NaHCO3
或者:CO2 +3H2O + 2NaAlO2 =2Al(OH)3↓ + Na2CO3
②在A、B装置之间增加一个盛有饱和NaHCO3溶液的洗气瓶
解析
(1)根据已知的两个电离平衡常数,准确判断乳酸酸性强于碳酸,所以能制备CO2气体;
(2)掌握AlO2- 的性质,熟练书写有关方程式;
(3)乳酸具有挥发性,挥发的乳酸进入B装置,同样可以生成白色沉淀,要理解实验过程中的这个缺陷。
考查方向
考察了以下基本知识:
(1)基本实验能力,理解强酸制弱酸;
(2)常规元素及其化合物知识:AlO2- 的性质;
(3)实验综合素养,理解实验过程中的缺陷。
解题思路
(1)根据已知的两个电离平衡常数,要理解强酸制弱酸;
(2)掌握AlO2- 的性质;
(3)认识乳酸可能具有挥发性,理解实验过程中的缺陷。
易错点
(1)化学方程式容易写成离子方程式;
(2)对物质性质掌握不牢固,化学方程式写错;
(3)未理解乳酸挥发性带来的缺陷。
教师点评
本小题考察了实验基本功,要根据电离平衡常数大小判断酸性强弱。
29.某校化学小组的同学开展测定

(1)甲同学用图1所示装置,把Xg的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积。实验开始时检查该装置气密性的方法是( )。
(2)乙同学用图2装置测定CO2的质量,该装置存在明显缺陷,从而导致实验误差,请你分析其中使测定结果可能偏大的主要原因 ( );使测定结果可能偏小的主要原因( ) 。(上述偏大、偏小的原因各写一条)
(3)丙同学用图3代替图1中的发生、收集装置,甲、乙两试管各有两根导管,用耐酸橡胶管连接对应接口后,倒置盛稀硫酸的试管,发生反应,放出气体,则
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
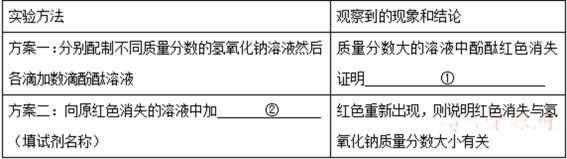
27.甲、乙、丙、丁四位同学在探究“碱溶液与酚酞作用”的实验时,发现了一个意外现象:氢氧化钠溶液滴人酚酞试液,溶液变成了红色,一会儿红色就消失了。
[猜想]
甲:可能是酚酞变质造成的;
乙:可能是氢氧化钠溶液与空气中的二氧化碳反应的缘故;
丙:可能是酚酞与空气中的氧气反应,使红色消失;
丁:可能与氢氧化钠溶液质量分数大小有关。
[理论分析]
(1)甲同学刚提出自己的猜想,就遭到其余三位同学的否定,三位同学的理由是:____________。
(2)丙同学认为乙同学的猜想也不正确,他的理由是_______________。
[实验设计]
(3)为证实丙同学的猜想,还需做如下实验,请完成下表:
(4)通过以上实验,四位同学看到:溶液先变成红色,一会儿红色仍然消失。因此酚酞红色褪去与氧气无关。若丁同学的猜想正确,设计如下实验证明并完成有关问题:
正确答案
(1)若酚酞变质,遇NaOH溶液就不会显红色。
(2)因为NaOH与空气中的CO2反应后的产物是Na2CO3,溶液仍然呈碱性。
(3)① 除去溶液的氧气 ② 利用植物油隔绝空气
(4)① 红色消失与氢氧化钠的质量分数大小有关 ② 水
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析