- 化学能与热能的相互转化
- 共33题
5.将

正确答案
解析
A.浊液中的沉淀是4BaSO,存在的沉淀溶解平衡正确。
B.在滤液b中24NaSO已经是剩余状态,因此再加24NaSO,不会出现沉淀。
C.该反应充分反应后,溶液中的成分有没反应完的24NaSO,加入2BaCl生成沉淀。
D.滤液b中含有Cl,加入硝酸银后生成白色沉淀。
考查方向
解题思路
由分析可得浊液中存在的沉淀为BaSO4,由此写出沉淀溶解平衡公式。向滤液氯化钠溶液中分别添加该三种物质,可以根据反应方程式判断选项中的现象是否正确。
易错点
向氯化钠溶液中添加硝酸银,会出现白色沉淀。
知识点
4.下列根据实验现象得出的结论正确的是()
正确答案

解析
A.可能铁粉不足,铜离子未反应,故A错误;
B.将Fe(NO)2样品溶于稀H2SO4后,酸性条件下,NO3-能把Fe2+氧化为Fe3+,滴加KSCN溶液变红,不能说明Fe(NO3)2晶体已经变质,故B错误;
C.KBrO3溶液中加入少量苯,然后通入少量Cl2,有机相呈橙色,说明该反应中有Br2生成,Br元素化合价由+5价变为0价,所以KBrO3是氧化剂,则Cl2是还原剂,Br2是还原产物,所以不能说明氧化性Cl2>Br2,故C错误;
D.葡萄糖溶液与新制Cu(OH)2混合加热,生成了砖红色沉淀,证明了葡萄糖分子中含有醛基,该实验能够达到实验目的,故D正确.
考查方向
解题思路
A.可能铁粉不足;
B.酸性条件下,NO3-能把Fe2+氧化为Fe3+;
C.KBrO3溶液中加入少量苯,然后通入少量Cl2,有机相呈橙色,说明该反应中有Br2生成,Br元素化合价由+5价变为0价,所以KBrO3是氧化剂,则Cl2是还原剂;
D.葡萄糖分子中含有醛基,能够与新制氢氧化铜浊液反应生成砖红色的氧化亚铜沉淀.
易错点
实验基本操作和实验原理的考查较细致,学生答题时容易出错。
知识点
2.下列说法正确的是( )。
正确答案
解析
丁烷有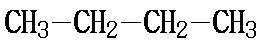

考查方向
解题思路
掌握同分异构体书写的方法、理解同系物的概念、活用判断反应自发性。
易错点
同分异构体的书写及自由能判据的运用。
知识点
3.某有机化合物M的结构简式为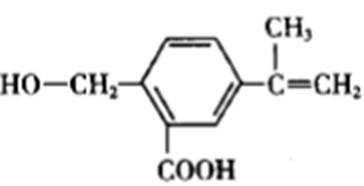
正确答案
解析
该有机物分子式为C11H12O3,A错误。该有机物官能团有碳碳双键、醇羟基、羧基。因含有羧基,故能与碳酸钠反应,每摩尔碳酸钠最多消耗2mol该有机物,B错误。有机物中能与醇、酸等发生酯化反应,因含有碳碳双键能与氢气发生加成反应(还原反应),也能被酸性高锰酸钾氧化,C正确。有机物分子中不含有醛基,故不能与新制氢氧化铜反应,D错误。
考查方向
解题思路
加强有机物结构、性质的知识加化
易错点
官能团性质把握不定
知识点
3.在某温度时,将n mol•L-1氨水滴入10mL 1.0 mol•L-1盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )
正确答案
解析
解:A.水的离子积与温度有关,a点时溶液温度小于25℃,则水的离子积Kw<1.0×10-14 mol2•L-2,故A错误;
B.b点溶液温度最高,说明此时两溶液恰好反应生成氯化铵,铵根离子水解促进了水的电离,则a、d两点都抑制了水的电离,则b点水的电离程度最大;由于d点混合液的pH不知,则无法判断a、d两点水的电离程度大小,故B错误;
C.b点时溶液的pH<7,则c(H+)>c(OH-),根据电荷守恒可知:c(Cl-)>c(NH4+),溶液中正确的离子浓度大小为:c(Cl-)>c(NH4+)>c(H+)>c(OH-),故C错误;
D.根据图象可知,25℃时溶液的pH=7,则:c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.05mol/L,根据物料守恒可知:c(NH3•H2O)=(0.5n-0.5)mol/L,则25℃时NH4Cl水解常数为:
故选D.
考查方向
解题思路
A.根据图象可知,a点时溶液温度小于25℃,则水的离子积小于1.0×10-14 mol2•L-2;
B.b点时溶液温度最高,说明氨水与盐酸恰好反应,则b点溶质为氯化铵,铵根离子促进了水的电离,则此时水的电离程度最大;由于d点溶液pH未知,则无法判断a、d两点水的电离程度大小;
C.该关系c(NH4+)>c(Cl-)>c(H+)>c(OH-)不满足电荷守恒;
D.25℃时溶液的pH=7,则c(H+)=c(OH-)=10-7 mol•L-1,c(NH4+)=c(Cl-)=0.5mol/L,根据物料守恒可知:c(NH3•H2O)=(0.5n-0.5)mol/L,然后结合铵根离子的水解平衡常数表达式计算.
易错点
本题将中学常见的酸碱中和滴定的图象与反应过程中的温度变化曲线放在一起,干扰了学生对原有熟知图象中重要点的利用。本题中对于温度曲线不会合理利用,使得对于b点是两溶液恰好反应生成氯化铵这一信息提取较难。
知识点
3.常温下,向饱和氯水中逐滴滴入0. 1mol.L-1的氢氧化钠溶液,pH变化如右图所示,下列有关叙述正确的是()
正确答案
解析
A.①为饱和氯水,饱和氯水中存在次氯酸的电离平衡、水的电离平衡和氯气的溶解平衡,故A错误;
B.①到②的过程中,氯水中氢离子浓度逐渐减小,水的电离程度逐渐增大,当氯气和氢氧化钠溶液恰好完全反应时,水的电离程度达到最大,此时溶质为氯化钠和次氯酸钠,溶液呈碱性,而②点为中性,说明②到③的过程中水的电离程度先增大,之后氢氧化钠过量后水的电离程度开始减小,故B错误;
C.当氯气与氢氧化钠溶液恰好反应时生成氯化钠、次氯酸钠和水,次氯酸根离子部分水解,溶液呈碱性,而②的pH=7,为中性溶液,说明氯水稍过量,二者没有恰好反应,故C错误;
D.②点溶液中溶质为NaCl、NaClO、HClO,溶液呈中性,则c(H+)=c(OH﹣),根据电荷守恒得:c(H+)+c(Na+)=c(Cl﹣)+c(ClO﹣)+c(OH﹣),所以c(Na+)=c(Cl﹣)+c(ClO﹣),由电物料守恒可得:c(Cl﹣)=c(ClO﹣)+c(HClO),所以c(Na+)=c(HClO)+2c(ClO﹣),故D正确。
故选D.
考查方向
解题思路
A.①点所示溶液中只存在HCl0的电离平衡、氯气的溶解平衡和水的电离平衡;
B.当氯气与氢氧化钠溶液恰好反应生成氯化钠、次氯酸钠和水时,水的电离程度达到最大,而②点pH=7,说明②到③的过程中水的电离程度先最大后减少;
C.当恰好反应时溶液显示碱性,而②点为中性;
D.②点溶液呈中性,则c(H+)=c(OH﹣),根据电荷守恒得c(H+)+c(Na+)=c(Cl﹣)+c(ClO﹣)+c(OH﹣),所以c(Na+)=c(Cl﹣)+c(ClO﹣),由电子转移守恒c(Cl﹣)=c(ClO﹣)+c(HClO),联立计算判断。
知识点
4. 如图甲是一种利用微生物将废水中的尿素(H2NCONH2,氮元素显-3价)的化学能直接转化为电能,并生成对环境无害物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中不正确的是 ( )
正确答案
解析
由图甲O2生成H2O 发生了还原反应,可知N为正极,M为负极,H十应移向正极,由左向右移动,A项正确。乙装置为电解池,电镀铜时,镀层金属Cu应当作为阳极,故应当与电源正极相连,B项正确。C项,尿素失电子生成CO2和N2,碳元素化合价没有变化,1 mol尿素失去6mol电子,正确。N电极发生的反应为:O2+4e-+4H+=2H2O,每消耗0.25 mol氧气时,转移1 mol,Cu2++2e-=Cu根据电子守恒,则铁电极析出0. 5 mol铜,质量应为32g。故 D项错误。
考查方向
解题思路
先分清二装置哪为电解池,哪为原电池。再根据电极通入的物质,与电极自身的属性分清正负极、与阴阳极。
易错点
电极反应方程式书写不当、原电池与电解池不能区分
知识点
4.下列反应的离子方程式正确的是()
正确答案
解析
明矾中加过量烧碱反应为:Al3+ + 4OH- = AlO2-+2H2O,A选项错误。
Fe(NO3)2提供NO3-,稀盐酸提供H+构成强氧化性环境,混合溶液中的I-与Fe3+都被氧化,反应方程式为:6Fe2+ + 6I-+16H+ + 4NO3- =6Fe3+ +4 NO↑ +3I2+ 8H2O,B选项错误。
碳酸氢铵溶液中加入足量的的氢氧化钠正确的离子方程式为:NH4++HCO3-+ 2OH- = CO32- + H2O+NH3.H2O,C错误。
碳酸钠溶液显碱性的原因是电离产生的碳酸根水解,D正确。
考查方向
解题思路
审清楚题,看清反应物量与量之间的关系
易错点
与量有关的离子方程式的书写、离子反应的先后顺序
知识点
实验室制备乙酸乙酯(CH3COOCH2CH3)时有如下副反应:
2CH3CH2OH
CH3CH2OH
相关有机化合物的一些性质如下表:
(CH3COOC2H5在饱和盐溶液中溶解度较小,C2H5OH能与CaCl2生成配合物)
装置如图所示(加热、支撑等装置略去)。
在三口瓶内先装入10mL95%乙醇与6mL浓硫酸混合液,并加入几粒沸石。在恒压滴液漏斗中加入15mL冰醋酸与15mL无水乙醇的混合液。加热,由恒压滴液漏斗逐滴加入混合液,并保持滴加速度与馏出液滴速度相近。保持反应液体温度在120—125℃,收集馏分。
8.写出实验室制取乙酸乙酯的化学方程式 。
9.①加热三口瓶,最好的方法是 (填选项)。
A.水浴
B.酒精灯
C.油浴
D.酒精喷灯
②若滴加液体速度太快会造成多种不利影响,其一是 。
10.产物提纯的流程如图:
①操作1的名称是 ,操作5的名称是 。
②加入饱和Na2CO3溶液的目的是为了除去 。
③加入饱和NaCl溶液是为了除去有机层中少量Na2CO3,其目的是 。
④加入饱和CaCl2溶液的目的是为了除去 ,加入无水MgSO4的目的是为了除去水。
⑤乙酸乙酯的产率是 。
正确答案
CH3COOH+CH3CH2OH
解析
本题是实验室制备乙酸乙酯,其反应原理是:CH3COOH+CH3CH2OH

考查方向
解题思路
本题是实验室制备乙酸乙酯,其反应原理是:CH3COOH+CH3CH2OH
易错点
Na2CO3溶液、NaCl溶液、CaCl2溶液的作用和分离的操作,产率的计算。
正确答案
① C
② 反应液体温度下降过快
(或不易控制反应液体温度或乙酸和乙醇还没反应就被蒸馏出来等)
解析
①为了使温度容易控制且加热均匀的控制在120—125℃,A.水浴加热控制的温度不能超过100℃,错误;B.酒精灯和D.酒精喷灯直接加热不能控制均匀加热;所以最好的方法是油浴,故答案为C;
②恒压滴液漏斗逐滴加入混合液,并保持滴加速度与馏出液滴速度相近。其目是反应物的温度能够保持恒定,反应物的转化率(或者产物产率)更高,若滴加液体速度太快,反应液体温度易快速下降。故答案反应液体温度下降过快(或不易控制反应液体温度或乙酸和乙醇还没反应就被蒸馏出来等);
考查方向
解题思路
①为了使温度容易控制且加热均匀的控制在120—125℃,最好的方法是油浴,
②由恒压滴液漏斗逐滴加入混合液,并保持滴加速度与馏出液滴速度相近。其目有反应物的温度能够保持恒定,反应物的转化率(或者产物产率)更高。
纯净的CH3COOCH2CH3 ,乙酸乙酯的产率=
易错点
Na2CO3溶液、NaCl溶液、CaCl2溶液的作用和分离的操作,产率的计算。
正确答案
① 分液 蒸馏
② 馏分中的酸性物质(或醋酸)
③ 防止生成CaCO3沉淀,在步骤3中堵塞分液漏斗
④ CH3CH2OH
⑤ 80%
解析
根据题设可知馏分CH3COOCH2CH3 (含有乙醇、乙酸、C2H5OC2H5、水等)加入饱和Na2CO3 溶液,作用是溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度。操作1(分液)可得水层1和有机层,
有机层再加入饱和NaCl溶液,作用是除去残留的Na2CO3 ,防止加入CaCl2生成CaCO3沉淀,堵塞分液漏斗,分液可得水层2和有机层,有机层再加入饱和CaCl2溶液(C2H5OH能与CaCl2生成配合物),作用是除去乙醇,有机层加无水MgSO4,作用是除水,最后进行操作5(蒸馏)可得纯净的CH3COOCH2CH3 ;
故答案为① 分液 蒸馏 ;② 馏分中的酸性物质(或醋酸);;③ 防止生成CaCO3沉淀,在步骤3中堵塞分液漏斗;④ CH3CH2OH;⑤由题设可知n(CH3CH2OH)=
n(CH3COOH)=
乙酸乙酯的产率=
考查方向
解题思路
根据题设可知馏分CH3COOCH2CH3 (含有乙醇、乙酸、C2H5OC2H5、水等)加入饱和Na2CO3 溶液,作用是溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度,后分液可得水层1和有机层,有机层再加入饱和NaCl溶液,作用是除去残留的Na2CO3 ,分液可得水层2和有机层,有机层再加入饱和CaCl2溶液(C2H5OH能与CaCl2生成配合物),作用是除去乙醇,有机层加无水MgSO4,作用是除水,最后进行蒸馏可得纯净的CH3COOCH2CH3 ,乙酸乙酯的产率=
易错点
Na2CO3溶液、NaCl溶液、CaCl2溶液的作用和分离的操作,产率的计算。
己二酸 
可能用到的有关数据如下:
实验步骤如下;I、在三口烧瓶中加入16 mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。II、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。III、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。V、粗产品经提纯后称重为5.7g。请回答下列问题:
27.仪器b的名称为__________。
28.向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果:_________________________________________________________________。
29.已知用NaOH溶液吸收尾气时发生的相关反应方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O NO+NO2+2NaOH =2NaNO2+H2O ;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:_____________________________、________________________________。
30.为了除去可能的杂质和减少产品损失,可分别用冰水和 洗涤晶体。
31.粗产品可用 法提纯(填实验操作名称)。本实验所得到的己二酸产率为 。
正确答案
(1)球形冷凝管(或冷凝管)
解析
看清字母标注的是什么仪器,直接做答。
考查方向
化学常见仪器的识别
解题思路
熟悉中学化学实验中常见的仪器,对仪器的名称、用途、使用注意事项都要烂熟于胸。
易错点
难度不大,但易写错字
教师点评
本小问较易,学生看清标,对仪器名称正确书写
正确答案
(2)反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中。
解析
由题干信息可知,反应过程会放出大量的热,引起反应液暴沸引起事故,再由化学方程式得知反应过程中会生成有毒的NO2气体,反应过快不利于碱液对尾气的吸收。
考查方向
实验操作及评价
解题思路
由题干信息及反应产物可知,反应过程会放出大量的热,引起反应液暴沸引起事故,再是反应会生成有毒的NO2气体,反应过快不利于碱液的吸收。
易错点
题干信息把握不准或回答不完整。
正确答案
(3) 2NO2+Na2CO3=NaNO2+NaNO3+CO2 NO+NO2+Na2CO3=2NaNO2+CO2
解析
由已知的二个反应得知,NO2与碱反应时充当氧化剂与还原剂,一部分价态升高,一部分价态降低,因此NO2与碳酸钠反应得到硝酸钠与亚硝酸钠,利用得失电子守恒与质量守恒进行配平,书写正确的化学方程式。
考查方向
化学反应方程式的书写
解题思路
根据已知的二个反应得知,NO2与碱反应时充当氧化剂与还原剂,一部分价态升高,一部分价态降低,因此NO2与碳酸反应也是如此。
易错点
不知掌握NO2与碱反应的实质,不明白NO2在反应中既作氧化剂又做还原剂。
正确答案
(4) 苯
正确答案
(5)重结晶 75%
扫码查看完整答案与解析













