- 化学能与热能的相互转化
- 共33题
4.下列根据实验现象得出的结论正确的是()
正确答案

解析
A.可能铁粉不足,铜离子未反应,故A错误;
B.将Fe(NO)2样品溶于稀H2SO4后,酸性条件下,NO3-能把Fe2+氧化为Fe3+,滴加KSCN溶液变红,不能说明Fe(NO3)2晶体已经变质,故B错误;
C.KBrO3溶液中加入少量苯,然后通入少量Cl2,有机相呈橙色,说明该反应中有Br2生成,Br元素化合价由+5价变为0价,所以KBrO3是氧化剂,则Cl2是还原剂,Br2是还原产物,所以不能说明氧化性Cl2>Br2,故C错误;
D.葡萄糖溶液与新制Cu(OH)2混合加热,生成了砖红色沉淀,证明了葡萄糖分子中含有醛基,该实验能够达到实验目的,故D正确.
考查方向
解题思路
A.可能铁粉不足;
B.酸性条件下,NO3-能把Fe2+氧化为Fe3+;
C.KBrO3溶液中加入少量苯,然后通入少量Cl2,有机相呈橙色,说明该反应中有Br2生成,Br元素化合价由+5价变为0价,所以KBrO3是氧化剂,则Cl2是还原剂;
D.葡萄糖分子中含有醛基,能够与新制氢氧化铜浊液反应生成砖红色的氧化亚铜沉淀.
易错点
实验基本操作和实验原理的考查较细致,学生答题时容易出错。
知识点
2.下列说法正确的是( )。
正确答案
解析
丁烷有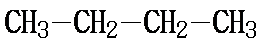

考查方向
解题思路
掌握同分异构体书写的方法、理解同系物的概念、活用判断反应自发性。
易错点
同分异构体的书写及自由能判据的运用。
知识点
3.某有机化合物M的结构简式为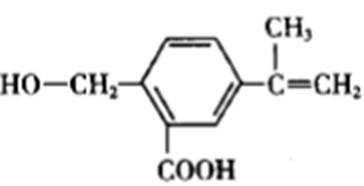
正确答案
解析
该有机物分子式为C11H12O3,A错误。该有机物官能团有碳碳双键、醇羟基、羧基。因含有羧基,故能与碳酸钠反应,每摩尔碳酸钠最多消耗2mol该有机物,B错误。有机物中能与醇、酸等发生酯化反应,因含有碳碳双键能与氢气发生加成反应(还原反应),也能被酸性高锰酸钾氧化,C正确。有机物分子中不含有醛基,故不能与新制氢氧化铜反应,D错误。
考查方向
解题思路
加强有机物结构、性质的知识加化
易错点
官能团性质把握不定
知识点
实验室制备乙酸乙酯(CH3COOCH2CH3)时有如下副反应:
2CH3CH2OH
CH3CH2OH
相关有机化合物的一些性质如下表:
(CH3COOC2H5在饱和盐溶液中溶解度较小,C2H5OH能与CaCl2生成配合物)
装置如图所示(加热、支撑等装置略去)。
在三口瓶内先装入10mL95%乙醇与6mL浓硫酸混合液,并加入几粒沸石。在恒压滴液漏斗中加入15mL冰醋酸与15mL无水乙醇的混合液。加热,由恒压滴液漏斗逐滴加入混合液,并保持滴加速度与馏出液滴速度相近。保持反应液体温度在120—125℃,收集馏分。
8.写出实验室制取乙酸乙酯的化学方程式 。
9.①加热三口瓶,最好的方法是 (填选项)。
A.水浴
B.酒精灯
C.油浴
D.酒精喷灯
②若滴加液体速度太快会造成多种不利影响,其一是 。
10.产物提纯的流程如图:
①操作1的名称是 ,操作5的名称是 。
②加入饱和Na2CO3溶液的目的是为了除去 。
③加入饱和NaCl溶液是为了除去有机层中少量Na2CO3,其目的是 。
④加入饱和CaCl2溶液的目的是为了除去 ,加入无水MgSO4的目的是为了除去水。
⑤乙酸乙酯的产率是 。
正确答案
CH3COOH+CH3CH2OH
解析
本题是实验室制备乙酸乙酯,其反应原理是:CH3COOH+CH3CH2OH

考查方向
解题思路
本题是实验室制备乙酸乙酯,其反应原理是:CH3COOH+CH3CH2OH
易错点
Na2CO3溶液、NaCl溶液、CaCl2溶液的作用和分离的操作,产率的计算。
正确答案
① C
② 反应液体温度下降过快
(或不易控制反应液体温度或乙酸和乙醇还没反应就被蒸馏出来等)
解析
①为了使温度容易控制且加热均匀的控制在120—125℃,A.水浴加热控制的温度不能超过100℃,错误;B.酒精灯和D.酒精喷灯直接加热不能控制均匀加热;所以最好的方法是油浴,故答案为C;
②恒压滴液漏斗逐滴加入混合液,并保持滴加速度与馏出液滴速度相近。其目是反应物的温度能够保持恒定,反应物的转化率(或者产物产率)更高,若滴加液体速度太快,反应液体温度易快速下降。故答案反应液体温度下降过快(或不易控制反应液体温度或乙酸和乙醇还没反应就被蒸馏出来等);
考查方向
解题思路
①为了使温度容易控制且加热均匀的控制在120—125℃,最好的方法是油浴,
②由恒压滴液漏斗逐滴加入混合液,并保持滴加速度与馏出液滴速度相近。其目有反应物的温度能够保持恒定,反应物的转化率(或者产物产率)更高。
纯净的CH3COOCH2CH3 ,乙酸乙酯的产率=
易错点
Na2CO3溶液、NaCl溶液、CaCl2溶液的作用和分离的操作,产率的计算。
正确答案
① 分液 蒸馏
② 馏分中的酸性物质(或醋酸)
③ 防止生成CaCO3沉淀,在步骤3中堵塞分液漏斗
④ CH3CH2OH
⑤ 80%
解析
根据题设可知馏分CH3COOCH2CH3 (含有乙醇、乙酸、C2H5OC2H5、水等)加入饱和Na2CO3 溶液,作用是溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度。操作1(分液)可得水层1和有机层,
有机层再加入饱和NaCl溶液,作用是除去残留的Na2CO3 ,防止加入CaCl2生成CaCO3沉淀,堵塞分液漏斗,分液可得水层2和有机层,有机层再加入饱和CaCl2溶液(C2H5OH能与CaCl2生成配合物),作用是除去乙醇,有机层加无水MgSO4,作用是除水,最后进行操作5(蒸馏)可得纯净的CH3COOCH2CH3 ;
故答案为① 分液 蒸馏 ;② 馏分中的酸性物质(或醋酸);;③ 防止生成CaCO3沉淀,在步骤3中堵塞分液漏斗;④ CH3CH2OH;⑤由题设可知n(CH3CH2OH)=
n(CH3COOH)=
乙酸乙酯的产率=
考查方向
解题思路
根据题设可知馏分CH3COOCH2CH3 (含有乙醇、乙酸、C2H5OC2H5、水等)加入饱和Na2CO3 溶液,作用是溶解乙醇,中和乙酸,降低乙酸乙酯的溶解度,后分液可得水层1和有机层,有机层再加入饱和NaCl溶液,作用是除去残留的Na2CO3 ,分液可得水层2和有机层,有机层再加入饱和CaCl2溶液(C2H5OH能与CaCl2生成配合物),作用是除去乙醇,有机层加无水MgSO4,作用是除水,最后进行蒸馏可得纯净的CH3COOCH2CH3 ,乙酸乙酯的产率=
易错点
Na2CO3溶液、NaCl溶液、CaCl2溶液的作用和分离的操作,产率的计算。
己二酸 
可能用到的有关数据如下:
实验步骤如下;I、在三口烧瓶中加入16 mL 50%的硝酸(密度为1.31g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。II、水浴加热三口烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。III、当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10min(注意控制温度),直至无红棕色气体生成为止。IV、趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后过滤、洗涤得粗产品。V、粗产品经提纯后称重为5.7g。请回答下列问题:
27.仪器b的名称为__________。
28.向三口烧瓶中滴加环己醇时,要控制好环己醇的滴入速率,防止反应过于剧烈导致温度迅速上升,否则.可能造成较严重的后果,试列举一条可能产生的后果:_________________________________________________________________。
29.已知用NaOH溶液吸收尾气时发生的相关反应方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O NO+NO2+2NaOH =2NaNO2+H2O ;如果改用纯碱溶液吸收尾气时也能发生类似反应,则相关反应方程式为:_____________________________、________________________________。
30.为了除去可能的杂质和减少产品损失,可分别用冰水和 洗涤晶体。
31.粗产品可用 法提纯(填实验操作名称)。本实验所得到的己二酸产率为 。
正确答案
(1)球形冷凝管(或冷凝管)
解析
看清字母标注的是什么仪器,直接做答。
考查方向
化学常见仪器的识别
解题思路
熟悉中学化学实验中常见的仪器,对仪器的名称、用途、使用注意事项都要烂熟于胸。
易错点
难度不大,但易写错字
教师点评
本小问较易,学生看清标,对仪器名称正确书写
正确答案
(2)反应液暴沸冲出冷凝管;放热过多可能引起爆炸;产生的二氧化氮气体来不及被碱液吸收而外逸到空气中。
解析
由题干信息可知,反应过程会放出大量的热,引起反应液暴沸引起事故,再由化学方程式得知反应过程中会生成有毒的NO2气体,反应过快不利于碱液对尾气的吸收。
考查方向
实验操作及评价
解题思路
由题干信息及反应产物可知,反应过程会放出大量的热,引起反应液暴沸引起事故,再是反应会生成有毒的NO2气体,反应过快不利于碱液的吸收。
易错点
题干信息把握不准或回答不完整。
正确答案
(3) 2NO2+Na2CO3=NaNO2+NaNO3+CO2 NO+NO2+Na2CO3=2NaNO2+CO2
解析
由已知的二个反应得知,NO2与碱反应时充当氧化剂与还原剂,一部分价态升高,一部分价态降低,因此NO2与碳酸钠反应得到硝酸钠与亚硝酸钠,利用得失电子守恒与质量守恒进行配平,书写正确的化学方程式。
考查方向
化学反应方程式的书写
解题思路
根据已知的二个反应得知,NO2与碱反应时充当氧化剂与还原剂,一部分价态升高,一部分价态降低,因此NO2与碳酸反应也是如此。
易错点
不知掌握NO2与碱反应的实质,不明白NO2在反应中既作氧化剂又做还原剂。
正确答案
(4) 苯
正确答案
(5)重结晶 75%
扫码查看完整答案与解析




