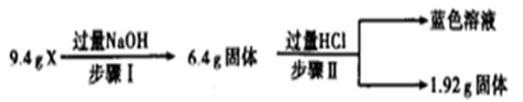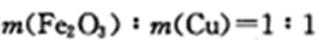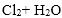- 有关混合物反应的计算
- 共90题
将含O2 和CH4的混合气体充入有23.4gNa2O2的密闭容器中,电火花点燃,反应结束后,容器内于150℃时压强约为0。将残留物溶于水,无气体逸出。下列叙述正确的是
正确答案
解析
略
知识点
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验:下列有关说法正确的是 ( )
正确答案
解析
略
知识点
现有一Na2SO3、Na2SO4混合物样品ag,为了测定其中Na2SO3的质量分数,设计了如下方案,其中明显不合理的是
正确答案
解析
略
知识点
向27.2克Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
正确答案
解析
略
知识点
在标准状况下,将SO2、HC1、H2组成的混和气体4.48L通过足量的NaOH溶液,溶液 的质量增加6.85 g,从溶液中逸出的气体经干燥后体积为1.12 L,则原混和气体中 SO2的体积为( )
正确答案
解析
略
知识点
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应如下:
C(s)+H2O(g)
(1)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为 。
(已知:H2S:Ka1=1.3×10-7 ,Ka2=7.1×10-15 ;H2CO3:Ka1=4.4×10-7 ,Ka2=4.7×10-11。)
(2)现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中发生如下反应:CO(g)+H2O(g)
该反应的
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO(g)
②CH4(g) +2NO2(g)
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示如图,NiO电极上NO发生的电极反应式: 。
(4)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V (NO)︰V(NO2)= 。
(5)在容积相同的两个密闭容器内 (装有等量的某种催化剂) 先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生①②两个反应:并在t秒时测定其中NOx转化率,绘得图象如图所示:
从图中可以得出的结论是
①
②
正确答案
Ⅰ(1)CO32- + H2S = HCO3-+ HS-
(2) < ; <
Ⅱ(3)NO–2e-+ O2-═ NO2
(4)1:1
(5)①相同温度下NO转化效率比NO2的低
②在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
解析
略
知识点
常温常压下过氧化钠可与CO2、H2反应,与CO、H2不反应。现将CO2、CO的混合气体在一定条件下和足量过氧化钠充分反应后,若固体质量增加了28 g,下列说法正确的是
正确答案
解析
略
知识点
一定质量的铜铁合金,完全溶于浓HNO3,若反应中硝酸被还原只产生3.36L的NO2气体、560 mL的N2O4气体和1.12升NO气体(都已折算到标准状况),反应后溶液中加入KSCN溶液,溶液不变红色。则合金的质量为
正确答案
解析
略
知识点
仅有一混合物的水溶液,只可能含有以下离子中的若干种:NH4+,Cl-,Mg2+,Ba2+,K+,CO32-,SO42-,现取三份100ml溶液进行如下实验:1 ,第一份加入硝酸银,有沉淀产生;2, 第二份加入足量NaOH溶液后加热,收集到气体0.04mol 3, 第三份加足量的BaCl2溶液后,得干燥沉淀6.27克,经足量盐酸洗涤,干燥后,沉淀质量是2.33克根据上述实验,以下推测正确的是
正确答案
解析
略
知识点
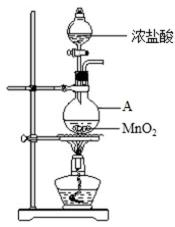
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。
(1)仪器A的名称为 ;
A中反应的离子方程式为 。
(2)甲同学将A中产生的气体通入下列溶液:
①实验a中的现象为 。
②不能证明产生的气体中含有HCl的实验是 (填字母序号)。
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因: 。
(4)已知:2S2O32- + I2 === S4O62- + 2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
I.测定X中溶解的Cl2。取25.00 mL溶液X,加入过量KI溶液,然后用0.04 mol•L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液V mL。
II.测定X中Cl元素总量。另取25.00 mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10 mol•L-1 AgNO3溶液滴定所得溶液中的Cl-。
① X中的HClO不会影响I的测定结果,原因是 。
② 由I、II 中实验数据可证明A中产生的气体中含有HCl,则II中消耗0.10 mol•L-1 AgNO3溶液的体积应大于 mL(用含V的代数式表示)。
正确答案
见解析。
解析
(1)圆底烧瓶 MnO2 + 4H++ 2Cl-
(2)①溶液先变红再褪色
②a、b
(3)Cl2+ H2O
(4)
①答案一:生成1 mol HClO需消耗1 mol Cl2, HClO也有氧化性,1 mol HClO和1 mol Cl2均能将2 mol KI氧化成I2。
答案二:


②0.4V
知识点
扫码查看完整答案与解析