- 有关混合物反应的计算
- 共90题
13.常温下,向10mL 0.1 mol·L-1的HR溶液中逐滴滴入0.1 mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是
正确答案
解析
A.体积图象可知b点溶液pH=7,此时HR与一水合氨的物质的量相等,二者恰好反应生成NH4R,铵根离子与R-的水解程度相等,故A错误;B. a~b点导电能力增强,说明反应后溶液中离子浓度增大,也证明HR在溶液中部分电离,为弱酸,故B正确;C.根据图象可知,c点时溶液的pH>7,混合液呈碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH4+)>c(R-),故C正确;D.常温下水的离子积为:KW=c(H+)×c(OH-)=1.0×10-14,由于b-c点溶液的反应温度相同,则水的离子积不变,故D正确;
本题正确答案是A
考查方向
解题思路
A.b点溶液pH=7,此时加入10mLHR,HR与一水合氨的浓度、体积相等,则二者恰好反应; B.根据图象可知,a~b点导电能力增强,说明HR为弱电解质,在溶液中部分电离,加入氨水后生成强电解质,离子浓度增大;C.c点时溶液的pH>7,混合液显示碱性,则c(OH-)>c(H+),结合电荷守恒可知:c(NH4+)>c(R-);D.b-c点,溶液的温度不变,则水的离子积不变.
易错点
离子浓度定性比较、溶液酸碱性与溶液pH的计算
知识点
20.相同状况下,pH=2的两种一元酸HX和HY的溶液分别取50mL,加入足量的表面积相同的镁粉,充分反应后,收集H2的体积(同温同压下)V(HX)>V(HY),下列说法正确的是
正确答案
解析
根据题意不难分析,两种酸已经全部反应完全,但是产生的气体体积V(HX)>V(HY),这说明HX所提供的氢离子大于HY,有由于初始PH相等,因而能充分说明HX没有完全电离,即为弱酸,但不能说明HY为强酸,且HX酸性弱于HY。
A.由于HX酸性更弱,水解程度更大,同等条件下碱性更强,故错误。C.反应开始之后,弱酸的反应速率快,所用时间不相同,故错误。
考查方向
解题思路
强电解质与弱电解质的本质区别在于是否完全电离
易错点
弱酸的电离平衡于PH,弱电解质的电离平衡移动
知识点
13.已知:2C(s)+O2(g)=2CO(g) ΔH=-217kJ·mol-1C(s)+H2O(g)=CO(g)+H2(g) ΔH=b kJ·mol-1H-H、O-H和O=O键的键能分别为436、462和495kJ·mol-1,则b为
正确答案
解析
①2C(s)+O2(g)=2CO(g) ΔH1=-217kJ·mol-1
②C(s)+H2O(g)=CO(g)+H2(g) ΔH2=b kJ·mol-1
H-H、O-H和O=O键的键能分别为436、462和495kJ·mol-1,
由②×2 - ①得:
③2H2O(g)=2H2(g)+O2(g) ΔH3=2ΔH2-ΔH1=(2b+217)kJ·mol-1
由【微观角度ΔH=E反应物总键能 - E生成物总键能】可知:
ΔH3=2b+217=4×462-(2×436+495),不难求出b值。
考查方向
热化学方程式的应用,盖斯定律的理解。
解题思路
又已知热化学方程式,推导出待求的热化学方程式,由给出的焓变,通过盖斯定律可以推导出来。ΔH有两种算法:
(1)宏观角度ΔH=E生成物 - E反应物;
(2)微观角度ΔH=E反应物总键能 - E生成物总键能。
易错点
微观角度求焓变时,反应物与生成物键能弄反了,或者化学键的个数计算错误。
教师点评
ΔH=E反应物总键能 - E生成物总键能有同学记不住这个公式。
知识点
1.化学与生活密切相关,下列说法正确的是()
正确答案
解析
A、绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染,而不是产生污染再治理,故A错误;
B、钙不是微量元素,钙在人体内是常量元素,故B错误;
C、食盐可以做食品的防腐剂,如用食盐来腌制食品能防止腐烂,故C错误;
D、“地沟油”的成分是油脂,可用来制肥皂和生物柴油,故D正确;
考查方向
解题思路
A、绿色化学的核心是提高原子利用率减少污染;
B、钙不是人体必不可少微量元素;
C、食盐具有咸味,常用作调味品和防腐剂;
D、“地沟油”的成分是油脂.
易错点
人体必不可少的微量元素; 食盐作食品防腐剂。
知识点
22.在含有2mol复盐NH4Al(SO4)2的溶液中加
正确答案
解析
2mol复盐NH4Al(SO4)2的溶液中电离产生2molNH4+、2molAl3+和4molSO42-,设加入氢氧化钡为xmol,当铝离子未完全沉淀,所以沉淀的质量为: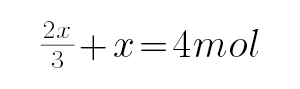
考查方向
化学方程式的计算
解题思路
两溶液混合,发生反应Ba2++SO42-=BaSO4↓,同时发生Al3++OH-=Al(OH)3↓,当Al3+反应完了,OH-再和NH4+反应:NH4++OH-=NH3•H2O,根据硫酸钡求出Ba2+的物质的量,进而计算出加入的OH-总量,再计算出Al3+完全反应消耗OH-的物质的量,根据离子方程式计算生成Ba(OH)2的物质的量
易错点
Al3+和NH4+与OH-离子反应顺序
教师点评
本题考查化学方程式有关计算,为高频考点,明确离子反应先后顺序及氢氧化铝性质是解本题关键
知识点
扫码查看完整答案与解析
