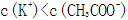- 酸碱混合时的定性判断及有关pH的计算
- 共38题
下列图示与对应的叙述相符的是
正确答案
解析
本题考查学生对化学反应热效应、酸碱中和滴定、溶解度曲线、平衡转化率等角度的理解能力。是基本理论内容的综合。高三复习要多注重这一方面的能力训练。
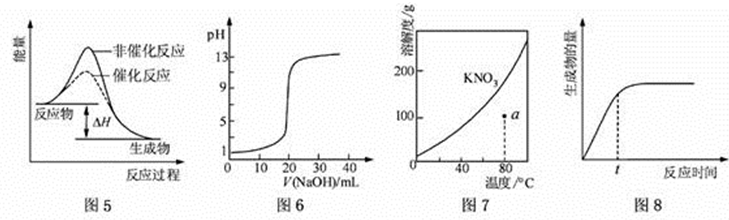
A.图5表示反应物总能量大于生成物总能量,是放热反应。
B.图6中当NaOH与CH3COOH等物质的反应时,溶液因盐类水解而呈碱性,突跃该曲线前。
C.图7通过a作一条辅助线,与KNO3的溶解度曲线有一交点在a点之上,说明a点溶液是不饱和溶液。
D.图8 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时曲线并没有达到平衡,所以反应物的转化率并不是最大。
知识点
下列说法正确的是
正确答案
解析
水的离子积常数只与温度有关,温度越高,Kw越大,A错;SO2通入碘水中被I2氧化生成SO42-,B错;加入铝粉能产生H2的溶液可能是强酸性溶液,也可能可能是强碱性溶液,在强酸性溶液中不可能存在AlO2―和NO3-(硝酸与铝反应不生成氢气),在强碱性溶液中,C中离子互不反应,可以大量共存,C正确;100℃时,Kw=1×10-12,所以pH=2的盐酸c(H+)= 0.01mol/L,pH=12的NaOH溶液的c(OH―)=1mol/L,等体积混合时碱过量,溶液显碱性,D错。
知识点
常温下a mol/L CH3COOH稀溶液和b mol/L KOH稀溶液等体积混合,下列判断一定错误的是
正确答案
解析
本题考查电解质溶液的知识,意在考查考生思维的缜密性。若a=b,恰好反应生成弱酸强碱盐CH3COOK,溶液呈碱性,A项正确;若a>b,反应后溶液中溶质为CH3COOK和CH3COOH,该溶液可能呈中性,则C项正确;若该溶液含CH3COOH很少,CH3COOH的电离程度小于CH3COO-的水解程度,溶液呈碱性,则溶液中c(K+)>c(CH3COO-),B项正确;若溶液中c(K+)<c(CH3COO-),利用电荷守恒知溶液中一定存在c(H+)>c(OH-),溶液显酸性,而a<b,溶液一定呈碱性,二者矛盾,D项一定错误。
知识点
室温时,将浓度和体积分别为




正确答案
解析
当NaOH和CH3COOH按照等物质的量反应时,形成的是强碱弱酸盐,显碱性,PH>7,而NaOH过量时,其PH也大于7,故A错误;B项符合电荷守恒关系式;当PH=7时,CH3COOH的物质的量需大于的NaOH物质的量,若V1=V2,一定是C2>C1,C项正确;若V1=V2,C1=C2,则NaOH和CH3COOH恰好中和,依据物料守恒,知D项正确。
知识点
下列叙述不正确的是( )
正确答案
解析
A项的命题意图是考查溶液电中性,但忽视了H2PO4-的存在,错误;B项中醋酸过量,混合后溶液呈酸性,正确;碱和酸均抑制水的电离,而可水解的盐则促进水的电离,C项正确;D项中因Ag+和氨水可形成络离子而使AgCl的溶解平衡右移,故AgCl在氨水中溶解度增大,正确。
知识点
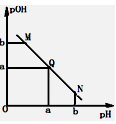
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则
正确答案
解析
由于醋酸是弱酸,电离程度很小,离子浓度也较小,M点溶液的导电能力最弱,A错;N点所示溶液为碱性,根据溶液电荷守恒易判断出此时c(Na+)>c(CH3COO-),B错;由于M点的H+浓度等于N点的OH-浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,C正确;Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性。则所加NaOH溶液体积略小于醋酸溶液的体积,D错。
知识点
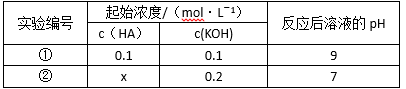
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
下列判断不正确的是
正确答案
解析
由表中①的HA为弱酸且酸碱物质的量相等,因此得A正确;由①中电荷守恒得[OH-]=[K+]-[A-]+[H+]=Kw/1X10-9 mol/L,故B错误;C中由②得X>0.2mol/L,故C正确;由电荷守恒得D正确
知识点
对于常温下pH为2的盐酸,叙述正确的是
正确答案
解析
电荷守恒A对。B 氨水过量,显碱性。D,反应后生成乙酸和氯化钠,水溶液为酸性。
知识点
25℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是( )
正确答案
解析
pH为7,说明混合后的溶液显中性,根据溶液中的电荷守恒c(Na+)+c(H+)=c(OH-)+c(A-),可知c(Na+)=c(A-),故C正确。若HA为强酸,则a=b,若HA为弱酸,则应是a>b,现在不知是强酸还是弱酸,故无法确定a和b的关系。
知识点
常温下用pH为3的某酸溶液分别与pH都为11的氨水、氢氧化钠溶液等体积混合得到a、b两种溶液,关于这两种溶液酸碱性的描述正确的是
正确答案
解析
a溶液分为四种情况①若酸为强酸,则反应后氨水有剩余,溶液呈碱性;②若酸为弱酸且酸的电离程度比氨水还弱,则溶液呈酸性;③若酸为弱酸且酸的电离程度比氨水强,则溶液呈碱性;④若酸为弱酸且酸的电离程度与氨水相同,则溶液呈中性。b溶液分为两种情况:①若酸为强酸,则二者恰好反应生成强酸强碱盐,溶液呈中性;②若酸为弱酸,则反应后酸有剩余,溶液呈酸性。
知识点
扫码查看完整答案与解析