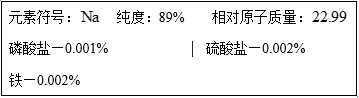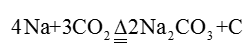- 物质检验实验方案的设计
- 共27题
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一:焦亚硫酸钠的制取
采用右图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5。
(1)装置I中产生气体的化学方程式为________。
(2)要从装置II中获得已析出的晶体,可采取的分离方法是________。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
实验二:焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________(填序号)。
a. 测定溶液的pH
b. 加入Ba(OH)2溶液
c. 加入盐酸
d. 加入品红溶液
e. 用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是________。
实验三:葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果________(填“偏高”“偏低”或“不变”)。
正确答案
(1)Na2SO3+H2SO4=Na2SO4+SO2↑+H2O或Na2SO3+2H2SO4=2NaHSO4+SO2↑+H2O
(2)过滤
(3)d
(4)a、e
(5)取少量Na2S2O5晶体于试管中,加适量水溶解,滴加足量盐酸,振荡,再滴入氯化钡溶液,有白色沉淀生成
(6)①0.16;②偏低
解析
略。
知识点
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
请回答:
(1)绿矾的化学式为 。
(2)写出反应①的化学方程式 ,
反应②生成沉淀的离子反应方程式 。
(3)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选): 。
(4)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是 。
(5)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为无色 液体,则反应④的总化学方程式为 ;若不考虑绿色化学工艺,所选试剂Y为1mol/L的硝酸,欲使3molCu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则需该硝酸的体积 L。
正确答案
(1)(2分) FeSO4·7H2O
(2)(4分)2Al+2NaOH+2H2O

((或2AlO2-+CO2+3H2O
1分,离子符号错0分]
(3)(3分) 用试管取少量滤液D(1分),向滤液中滴加KSCN(或NaSCN、或NH4SCN)]
溶液无明显现象(1分),再滴入氯水(或双氧水,或通入Cl2)若变成血红色,则溶
液则中存在Fe2+(1分)。
(4)(2分)铜、铁与稀硫酸形成了原电池(或发生了电化腐蚀,或有电流产
生)
(5)(5分) Cu+H2O2+H2SO4
2(3分)[说明:反应式为3Cu+2HNO3+3H2SO4
解析
略
知识点
氨、氯气和溴是中学化学实验中的常见试剂:
(1)实验室利用反应:
上述装置设计尚存在铼陷,应在__________ (填上述仪器字母序号)之间再加一个装置,请画出该装置(注明所需试剂)。
(2)实验室用C12从盐湖苦卤(富含K+、Ca2+、Mg2+、Br-、SO42-、C1-等)中提取较纯净的氯化钾晶体及液溴,流程如下:
①步骤I中液体静置分层后,从分液漏斗中分离出无色溶液A的具体操作过程为
②加入试剂x的目的是_______;步骤Ⅳ中试剂Y的化学式为_______;
③步骤V中蒸发溶液D时需要的仪器除酒精灯、三脚架外还需_______。
(3)Br2和FeCl3的稀溶液均呈黄色。将少量稀溴水滴入稀Fecl2溶液得黄色溶液,某同学设计实验验证二者混合能否发生反应:取少量混合溶液,加入淀粉碘化钾溶液,振荡溶液变蓝色,则二者未发生化学反应。该实验设计不正确,错误在于_______。
设计合理实验检验溴水和FeC12溶液是否发生化学反应(简要说明实验步骤、现象和结论)_______。
正确答案
(1)A;吸收反应产生的水;AB;作图如下:
(2)①先打开分液漏斗上口玻璃塞,或使塞上凹槽(或小孔)对准漏斗上的小孔,再拧开分液漏斗下口活塞,使下层液体慢慢沿烧杯壁流下,当下层液体流完后迅速关闭下口活塞,将无色液体A从上口倒出。;②除去SO42-;K2CO3;③蒸发皿、玻璃棒
(3)因为Br2和Fe3+都能把I-氧化成I2,使溶液变蓝,无法得出结论;取少量黄色混合溶液,滴加KSCN溶液,溶液变为血红色,说明二者发生化学反应,反之则不反应。
解析
略。
知识点
利用已有的实验器材,规格和数量不限,能完成相应实验的是
正确答案
解析
略
知识点
下列实验结论不正确的是
正确答案
解析
略
知识点
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
I. 将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2,制得混有SiCl4杂质的TiCl4。
II. 将混有SiCl4杂质的TiCl4分离,得到纯净的TiCl4。
III. 在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O。
IV. TiO2·xH2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是_______。II中所采取的操作名称_______。
②如实验IV中,应将TiO2.xH2O放在_______ (填仪器编号)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2→2O b. O+H2O→2OH(羟基) c. OH+OH→H2O2
①b中破坏的是 (填“极性共价键”或“非极性共价键”)。
②H2O2能清除路面空气中的
(3)过氧化氢是重要的化学试剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。
请填写下列空白:
①取10.00 mL密度为P g/mL的过氧化氢溶液稀释至250 mL。取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数配平及化学式填写在方框里。


②滴定时,将高锰酸钾标准溶液注入______________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是____________________________。
③重复滴定三次,平均耗用C mol/L KMnO4标准溶液 V mL,则原过氧化氢溶液中过氧化氢的质量分数为______________。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________ (填“偏高”或“偏低”或“不变”)。
正确答案
(1)①液态 ; 蒸馏 ② b
(2)①极性共价键 ②氧化性
(3)①2 5 6 2 8 ; 5O2 ↑
②酸式(1分)滴入最后一滴高锰酸钾溶液时,溶液呈浅红色,且半分钟内不褪色
(2分)
③
④偏高
解析
略
知识点
25.某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一制取氯酸钾和氯水
利用右图所示的实验装置进行实验。
(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。该实验操作过程需要的玻璃仪器有______。
(2)若对调B和C装置的位置,_____(填“能”或 “不能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的探究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3 。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
①系列a实验的实验目的是_______。
②设计1号试管实验的作用是___________。
③若2号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物唯一,还原产物为KCl,则此反应的离子方程式为_________________。
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用右图装置,加热15.0ml饱和氯水试样,测定产生气体的体积。此方案不可行的主要原因是_______。(不考虑实验装置及操作失误导致不可行的原因)
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操
作过程的细节):______
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯水可被SO2、H2O2、FeCl2等物质还原成Cl-。
正确答案
(1)烧杯、漏斗、玻璃棒、胶头滴管(不填“胶头滴管”也可);
(2)能;
(3)①研究反应体系中硫酸浓度对反应产物的影响;②硫酸浓度为0的对照实验;③ClO3-+6I-+6H+=Cl-+3I2+3H2O
(4)因存在Cl2的重新溶解、HClO分解等,此方案无法测算试样含氯总量(或其他合理答案)。(5)量取一定量的试样,加入足量的H2O2溶液,加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,称量沉淀质量(或其他合理答案)。
试题分析:(1)制取实验结束后,取出B中试管冷却结晶、过滤、洗涤。根据进行该实验操作过程使用的仪器可知:在该实验操作过程需要的玻璃仪器有烧杯、漏斗、玻璃棒、胶头滴管;
(2)Cl2与热的KOH溶液发生反应产生氯酸钾和氯化钾及水,与冷的KOH发生反应产生的在KCl、KClO和水。因此若对调B和C装置的位置,可以除去Cl2中的杂质HCl气体,故能提高B中氯酸钾的产率。
(3)

(4)该小组设计的实验方案为:使用右图装置,加热15.0ml饱和氯水试样,测定产生气体的体积。此方案不可行,主要原因是在溶液中存在Cl2的重新溶解及HClO分解产生HCl和氧气等。
(5)由于次氯酸会破坏酸碱指示剂,因此实验设计时不用酸碱指示剂,可以利用氯水的强氧化性,向该溶液中加入足量的足量的H2O2溶液,发生氧化还原反应产生Cl-,H2O2被氧化变为O2,然后加热除去过量的H2O2,冷却,再加入足量的硝酸银溶液,发生沉淀反应形成AgCl沉淀,称量沉淀质量可根据物质的元素组成确定其中含有的氯元素的质量。
解析
解析已在路上飞奔,马上就到!
知识点
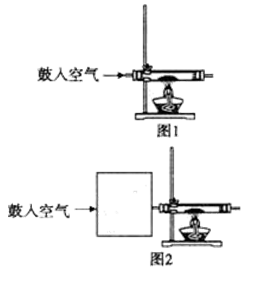
27.某化学兴趣小组在按图1装置做钠在空气中燃烧的实验时,观察到产物不仅仅有淡黄色的固体生成,还有少量的黑色颗粒产生,该小组对黑色颗粒进行了如下探究:
(1)甲同学查阅资料知:钠与二氧化碳反应生成一种钠的正盐和一种黑色颗粒。据此推测黑色颗粒是( )。写出生成该黑色颗粒的化学方程式:( ) 。
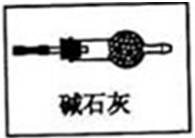
(2)乙同学认为只要将上述实验稍作改进,即可证明甲同学的猜想是否合理,请在图2的方框中画出装置图并注明相关药品的名称。
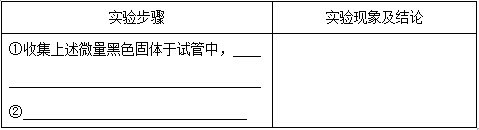
(3)丙同学按照乙同学的实验方案进行实验后,仍发现微量的黑色固体,于是认为可能是金属钠含有其它杂质,他发现在保存钠的试剂瓶的标签上有如下内容:
结合以上信息,丙同学认为微量黑色固体是铁的氧化物,请设计一简单实验证明丙的结论:
(4)结合以上三位同学的实验研究,你认为图1实验中的黑色颗粒组成为 ( )(填名称)。
正确答案
(1)炭黑 ;
(2)
(3)
(4)炭黑和铁的氧化物
解析
解析已在路上飞奔,马上就到!
知识点
28.某课外活动兴趣小组欲用下列化学试剂在实验室里制取Cl2并验证Cl2的某些化学性质。实验试剂有:3mol/LH2SO4 、1mol/LNaOH 、MnO2、 0.01mol/LKMnO4 、 吸收少量SO2的NaOH溶液、 浓HCl 、紫色石蕊试液、饱和的NaCl溶液、BaCl2溶液、品红溶液。甲小组设计的实验装置图如下:用橡胶管把A、B、C、D各装置的接口连接起来,在B中加入吸收少量SO2的NaOH溶液,D中加入1mol/LNaOH溶液。请回答下列问题:
Ⅰ、 (1)写出仪器X的名称:__________;
(2)写出A中发生反应的化学方程式__________________________________________,
不能用E装置代替A装置的原因是 ;
(3) C装置的作用是_______________________________________________;
(4) 甲小组通过该实验要验证Cl2的___________(填漂白性、还原性或氧化性);
(5)乙小组认为甲小组设计的实验装置有缺陷,请你帮甲小组完善该装置。即还要在
____和_____(填A、B、C、D、E)装置间连接一个装有_______溶液的洗气装置。
Ⅱ、丙小组认为B装置反应一段时间后,B装置溶液(强碱性)中肯定存在Cl—、OH— 和
SO42—,可能还含有其它的阴离子。请你设计实验帮助丙小组探究该吸收液中可能存在的其它阴离子。
(1)提出合理假设
假设1:只存在_______或者只存在_______;
假设2:可能两者都_________ (填:“存在”或“不存在”)
(2)请设计实验验证假设的正确性。
( )
( )
正确答案
Ⅰ、 (1)分液漏斗
(2)

(3)安全缓冲,防倒吸
(4)氧化性
(5)A、B ;饱和食盐水
Ⅱ、(1)
(2)取适量吸收液于两只试管中,向一支试管中加入足量盐酸产生能使品红溶液褪色的气体,则有

解析
解析已在路上飞奔,马上就到!
知识点
29.生铁中除铁外,还含有其他元素,如碳元素和硫元素。其中碳主要以碳化铁的形态存在,它使生铁性能坚硬而脆,所以生铁的用途不大,一般用做炼钢的原料。某兴趣小组的同学们设计了下图所示的实验装置测定生铁中的含碳量(加热和夹持装置省略)。
请回答下列问题:
(1)硫在生铁中是有害元素,它使生铁产生热脆性。硫元素在生铁中最有可能存在的价态是__________(填正确答案标号)。
A. -2 B. 0 C. +4 D. +6
(2)需要加热的装置是__________(填装置标号)。
(3)若无D装置,最终所测定的生铁含碳量__________(填“偏高”或“偏低”或“无影响”)。
(4)烧杯E中发生反应的离子方程式为____________________。
(5)在C管中的样品充分反应后,将E中最终的沉淀过滤、洗涤、干燥,称其质量为bg,计算生铁中碳元素的质量分数为__________。
(6)有同学提出应该在C和D之间加设一套装置,该装置的作用是__________;还有同学提出在D和E之间也应该再接一套装置,该装置的作用是__________。
(7)反应完成后,欲检验生铁中含有硫元素,请你设计简单的实验方案(写出实验步骤、现象)________________________________________。
正确答案
(1)A
(2)C
(3)偏高
(4)
(5)
(6)防止D中液体倒吸 ; 检验二氧化硫已经除尽
(7)取少量D瓶溶液于试管中,滴加盐酸使其酸化,再滴入
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析