- 离子浓度大小的比较
- 共173题
8.25℃时,等体积pH都为4的NH4Cl溶液和硫酸溶液,下列有关说法正确的是( )
①两溶液中:c (H+)>c (OH-),且c (H+)·c (OH-)=1×10-14
②两溶液中由水电离出的c (H+)均为1×10-10 mol·L-1
③NH4Cl溶液中c (Cl-)>c (NH4+)>c (H+)>c (OH-)
④两溶液中分别投入足量的镁粉,充分反应后放出相同条件下的等体积的气体
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
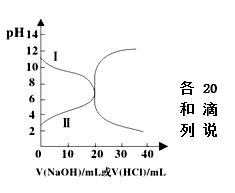
11.25℃时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如右图所示。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.常温下,0.1 mol/L某一元酸HA溶液中
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.下列溶液中微粒的物质的量浓度关系正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.常温下,0.1mol/L HX的pH=1,0.1 mol/LCH3COOH的pH=2.9。下列说法中不正确的()
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.德国化工学家哈伯于1905发明的合成氨工业对化学工业和国防工业具有重要意义。
下图为合成氨工业生产的示意图。
(1)图中条件选定的主要原因是(填字母)( )
A.温度、催化剂对化学平衡的影响
B.铁触媒在该温度时活性最大
C.工业生产受动力材料、设备等条件的限制
(2)在一定温度下,有甲、乙容积相等的容器
(I)向甲容器中通入3molN2和3molH2,反应达到平衡时,生成NH3 amol。此时NH3的物质的量分数是( )。
(II)向乙中通入2molNH3,欲使反应达到平衡时,各物质的浓度与(I)中平衡时相同,则起始时还需通入( )molN2。
(III)若起始时向乙中通入6molN2和6molH2达到平衡时,生成的NH3的物质的量为( )bmol,则a:b ( )1:2。(填“>”、“<”或“=”)
(3)随着对合成氨研究的发展,采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶簿膜做电极,实现了常压下高转化率的电解合成氨,装置如图所示。请回答:
该电解池中,钯电极B是电解池的( )极;则A电极上的电极反应式是( )。
(4)常温下,将pH = x的氨水和pH = y的盐酸(x、y均为正整数且x+y≥14)溶液等体积混合,某些同学分别认为混合液中的离子可能存在如下的关系,其中一定不正确的是( )(填序号)
① c(NH4+) > c(Cl—) > c(OH—) > c(H+)
② c(Cl—) > c(NH4+) > c(H+) > c(OH—)
③ c(NH4+) > c(OH—) > c(Cl—) > c(H+)
④ c(Cl—) = c(NH4+) > c(H+) = c(OH—)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.常温下,用0.1000 mol/L HCl溶液滴定 20.00 mL 0.1000 mol/L NH3•H2O溶液滴定曲线如右图。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.已知,常温下某浓度NaHSO3稀溶液的pH<7。则该稀溶液中下列粒子关系正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析