- 离子浓度大小的比较
- 共173题
5.向含有MgCO3固体的溶液中滴加少许浓盐酸(忽略体积变化),下列数值变小的是
正确答案
知识点
14.室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
正确答案
解析
A.pH=7,则c(H+)=c(OH﹣),结合电荷守恒可知,c(NH4+)=c(HCO3﹣)+2c(CO32﹣),故A错误;B.向0.10mol•L﹣1NaHSO3溶液中通入NH3,至溶液pH=7,反应生成Na2SO3和(NH4)2SO3,SO32﹣与NH4+水解程度相同,则c(Na+)>c(NH4+)=c(SO32﹣),故B错误;C.向0.10mol•L﹣1Na2SO3溶液通入SO2,发生Na2SO3+SO2+H2O=2NaHSO3,至溶液pH=7,反应后溶液中溶质为的NaHSO3、Na2SO3,则c(Na+) < 2[c(SO32-)+c(HSO3-)+c(H2SO3)],故C错误;D.向0.10mol•L﹣1CH3COONa溶液中通入HCl,至溶液pH=7,c(H+)=c(OH﹣),HCl不足,反应后溶液中溶质为NaCl、醋酸和醋酸钠,由电荷守恒可知,c(Na+)=c(CH3COO﹣)+c(Cl﹣),由物料守恒可知,c(Na+)=c(CH3COOH)+c(CH3COO﹣),则c(Na+)>c(CH3COOH)=c(Cl﹣),故D正确;故选D.
考查方向
解题思路
A.pH=7,则c(H+)=c(OH﹣),结合电荷守恒分析;B.向0.10mol•L﹣1NaHSO3溶液中通入NH3,至溶液pH=7,反应生成亚硫酸钠和亚硫酸氨,亚硫酸根离子与铵根离子水解程度相同;C.未反应前结合物料守恒可知c(Na+)=2[c(SO32﹣)+c(HSO3﹣)+c(H2SO3)],向0.10mol•L﹣1Na2SO3溶液通入SO2,至溶液pH=7,反应后溶液中溶质为NaHSO3、Na2SO3;
D.向0.10mol•L﹣1CH3COONa溶液中通入HCl,至溶液pH=7,反应后溶液中溶质为NaCl、醋酸和醋酸钠.
易错点
本题考查离子浓度大小比较,把握发生的反应、盐类水解及电离为解答的关键,注意pH=7的信息及应用,题目难度不大.
知识点
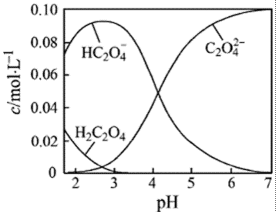
14.H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如右图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是
正确答案
解析
从图像中明显看出PH=2.5的溶液中c(H2C2O4)+ c(C2O42-)< c(HC2O4-),A错误;因c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)=0.100 mol·L-1,当c(Na+)=0.100 mol·L-1时,利用溶液中的电荷守恒和物料守恒,可以推出c(H+)+c(H2C2O4)=c(OH-)+ c(C2O42-),B选项正确;若有c(HC2O4-)= c(C2O42-),则c(Na+)<0.100 mol·L-1+ c(HC2O4-),C是错误的;当pH=7的中性溶液中,恰好是Na2C2O4溶液,其C2O42-会发生水解,即c(Na+)>2c(C2O42-)故BD正确。
考查方向
解题思路
该题综合性强,难度较大。电解质溶液中离子浓度大小比较问题,是高考热点中的热点。多年以来全国高考化学试卷几乎年年涉及。这种题型考查的知识点多,灵活性、综合性较强,有较好的区分度,它能有效地测试出学生对强弱电解质、电离平衡、水的电离、pH、离子反应、盐类水解等基本概念的掌握程度以及对这些知识的综合运用能力。围绕盐类水解的类型和规律的应用试题在高考中常有涉及。解决这类题目必须掌握的知识基础有:掌握强弱电解质判断及其电离,盐类的水解,化学平衡理论(电离平衡、水解平衡),电离与水解的竞争反应,以及化学反应类型,化学计算,甚至还要用到“守恒”来求解。
易错点
不能熟练用物料守恒、电荷守恒和质子守恒原理计算相关离子浓度大小。
知识点
14.室温下,下列叙述正确的是( )
正确答案
解析
本题只有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该小题得0分,若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
知识点
16.目前世界上比较先进的电解制碱技术是离子交换膜法。
(1)电解法制烧碱的主要原料是饱和食盐水。由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、
a.BaCl2
b.Na2CO3
c.NaOH
d.盐酸
e.KOH
(2)现有200 mL食盐水,用石墨电极电解。当阴极产生气体的体积为0.224 L(标准状况)时停止电解,此时阳极产生气体的体积也为0.224 L(标准状况),阳极的电极反应式为______________,电解过程中总反应的离子方程式为____________________,电解后,溶液在常温下的pH约为_________________(忽略体积变化)。
正确答案
(1)e
(2)2Cl-―2e- = Cl2↑ 2Cl-+2H2O
解析
(1)已知盐水中含有Ca2+、Mg2+、Fe3+、SO42-等,除去SO42-用BaCl2,除去Mg2+、Fe3+用NaOH,除去Ca2+用Na2CO3,除去过量的Na2CO3和NaOH用HCl,所以不应选用的试剂是:KOH,因为KOH会引入新的杂质K+,故答案为:e;
(2)电解食盐水时,C1-在阳极失电子生成氯气,其电极反应式为:2C1--2e-=C12↑;电解过程中总反应的离子方程式为2Cl-+2H2O





考查方向
解题思路
(1)根据盐水中含有的杂质选择试剂;
(2)电解食盐水时,C1-在阳极失电子生成氯气;阴极生成氢气,根据氢气的量求出氢氧化钠的量,然后求出PH;
易错点
本题考查除杂试剂的选择、电极反应式的书写、化学方程式的计算,难度不大,注意掌握化学方程式的计算是解题的关键。
知识点
扫码查看完整答案与解析