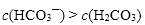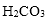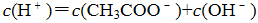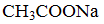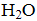- 离子浓度大小的比较
- 共173题
下列说法正确的是
正确答案
解析
略
知识点
常温时,下列叙述正确的是
正确答案
解析
略
知识点
25℃时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用浓度均为0.1 mol·L-1NaOH溶液和盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如右图所示。下列说法不正确的是
正确答案
解析
略
知识点
2SO2(g)+ O2 (g) 
(1)该反应是______反应(填“放热”或“吸热”)。
(2)400℃,1.01×105Pa时,将含10 mol SO2的原料气通入一密闭容器中进行反应,平衡时SO2的物质的量是______mol。
(3)硫酸厂尾气(主要成分SO2、O2和N2)中低浓度SO2的吸收有很多方法。
①用氨水吸收上述尾气,若SO2与氨水恰好反应得到碱性的(NH4)2SO3溶液时,则有关该溶液的下列关系正确的是______(填序号)。
a. c + c(NH3•H2O)= 2[c()+ c()+ c(H2SO3)]
b. c()+ c(H+)= c()+ c()+ c(OH-)
c. c()> c() > c(OH-) > c(H+)
②用 MnO2与水的悬浊液吸收上述尾气并生产MnSO4。
i. 得到MnSO4的化学方程式是______。
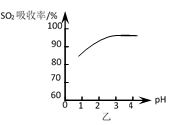
ii.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2吸收率与溶液pH的关系如图乙。
图甲中pH变化是因为吸收中有部分SO2转化为H2SO4,生成H2SO4反应的化学方程式是______;由图乙可知pH的降低______SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是______。
正确答案
见解析。
解析
(1)放热 0.08
(2)①ac
i. 
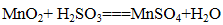
ii. 2SO2+ 2H2O +O2 === 2H2SO4
不利于 溶液中存在 SO2+ H2O 

知识点
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:下列判断不正确的是( )
正确答案
解析
略
知识点
人体血液中存在平衡:CO2 + H2O 

正确答案
解析
略
知识点
有25℃时0.1 mol/L的①氯化铵、②氯化钠、③醋酸钠三种溶液。下列有关判断不正确的是
正确答案
解析
略
知识点
某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是
正确答案
解析
略
知识点
下列溶液中有关物质的浓度关系正确的是
正确答案
解析
略。
知识点
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析