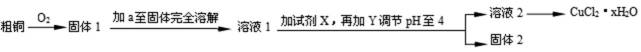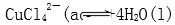- 金属的通性
- 共3题
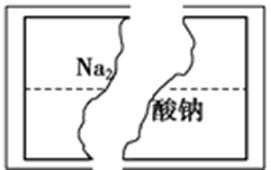
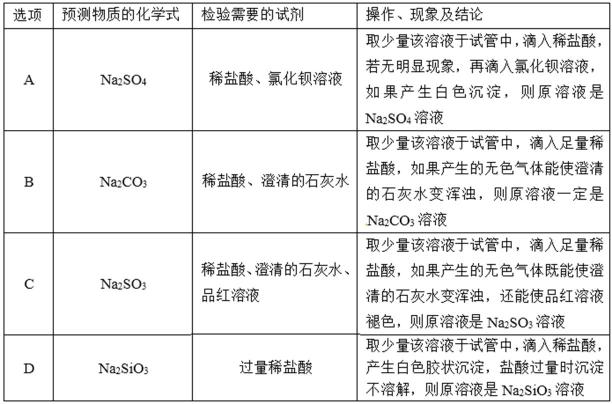
6.某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图。某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中错误的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论) ()
正确答案
解析
A.取少量该溶液于试管中,滴入稀盐酸,盐酸可排除其它离子的干扰,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,沉淀为硫酸钡,则原溶液是Na2SO4溶液,故A正确;
B.取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,无色气体时澄清石灰水变浑浊,气体可能为二氧化碳,或二氧化硫,则溶液可能为Na2CO3溶液,故B错误;
C.取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则气体为二氧化硫,所以则原溶液是Na2SO3溶液,故C正确;
D.取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,硅酸不溶于盐酸,则原溶液是Na2SiO3溶液,故D正确。
考查方向
解题思路
A.盐酸可排除其它离子的干扰,再滴加氯化钡产生白色沉淀,则沉淀为硫酸钡;
B.无色气体时澄清石灰水变浑浊,气体可能为二氧化碳,或二氧化硫;
C.无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则气体为二氧化硫;
D.硅酸不溶于盐酸.
易错点
离子的检验及气体的检验。
知识点
氯化铜用作陶瓷着色剂、玻璃、电镀添加剂、催化剂、照相制版及饲料添加剂等。某学习小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。
已知氯化铜易溶于水,难溶于乙醇。
13.溶液1中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液1中Fe2+的试剂 (填编号)
①KMnO4
②K3[Fe(CN)6]
③NaOH
④KSCN
为了更完全的沉淀,试剂X为 。
14.试剂a是 ,加入需过量的原因是 。试剂Y用于调节pH以除去杂质,Y可选用下列试剂中的 (填序号)。
a.NaOH
b.NH3·H2O
c.CuO
d.Cu2(OH) 2CO3
e.CuSO4
调节pH至4的原因是 。
得到固体2的操作是 。
15.在溶液2转化为CuCl2·xH2O的操作过程中,发现溶液颜色由蓝色变为绿色。欲探究其原因。已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq)
蓝色 黄色
①上述反应的化学平衡常数表达式是K= 。若增大氯离子浓度,K值 (填“增大”、“减小”或“不变”)
16.② 取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是 (填序号)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
17.得到CuCl2·xH2O晶体最好采用的干燥方式是 。
18.为测定制得的氯化铜晶体(CuCl2·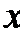
正确答案
② H2O2溶液
解析
由图示可知:粗铜和氧气反应生成氧化铜、四氧化三铁,加入稀盐酸至固体完全溶解,为了防止氯化铜等物质发生水解,加入过量稀盐酸得溶液1,再加入过氧化氢溶液将部分可能存在的亚铁离子氧化成三价铁离子,再加入碱式碳酸铜调节溶液的酸碱度至pH在4,使三价铁离子生成氢氧化铁除去,过滤可得固体2氢氧化铁和溶液2氯化铜溶液,蒸发结晶得氯化铜晶体(CuCl2·2H2O)。
铁氰酸钾(铁氰化钾),不和Fe3+、Cu2+反应,和Fe2+反应得到一种蓝色的沉淀,溶液1中的金属离子有Fe3+、Fe2+、Cu2+,能检验溶液1中Fe2+的试剂是②K3[Fe(CN)6],故选②;
为了更完全的沉淀,将铁离子和亚铁离子完全除去,应先将亚铁离子氧化成铁离子,同时又不带入杂质离子,试剂X为H2O2溶液;
考查方向
解题思路
由图示可知:粗铜和氧气反应生成氧化铜、四氧化三铁,加入稀盐酸至固体完全溶解,为了防止氯化铜等物质发生水解,加入过量稀盐酸得溶液1,再加入过氧化氢溶液将部分可能存在的亚铁离子氧化成三价铁离子,再加入碱式碳酸铜调节溶液的酸碱度至pH在4,使三价铁离子生成氢氧化铁除去,过滤可得固体2氢氧化铁和溶液2氯化铜溶液,蒸发结晶得氯化铜晶体(CuCl2·2H2O)。
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
正确答案
稀盐酸 盐酸充分反应,且能抑制Cu2+水解 cd;
为了使Fe3+完全沉淀而Cu2+不沉淀,可以调节pH至4 过滤
解析
将氧化铜、四氧化三铁溶解,应加入稀盐酸至固体完全溶解,试剂a是稀盐酸,加入需过量的原因是盐酸充分反应,且能抑制Cu2+水解。试剂Y用于调节pH以除去杂质铁离子,应该可以将酸碱度升高,而且不会带入杂质离子,Y可选用CuO 或Cu2(OH) 2CO3,故选cd;
因为pH=3时,Fe3+完全沉淀而Cu2+不沉淀,为了使Fe3+完全沉淀而Cu2+不沉淀,可以调节pH至4;
利用过滤将固液混合物分离,得到固体2和溶液2;
考查方向
解题思路
(2) 将氧化铜、四氧化三铁溶解,应加入稀盐酸至固体完全溶解,加入需过量的原因是盐酸充分反应,且能抑制Cu2+水解。调节pH以除去杂质铁离子,应该可以将酸碱度升高,而且不会带入杂质离子,可选用CuO 或Cu2(OH) 2CO3;pH=3时,Fe3+完全沉淀而Cu2+不沉淀;
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
正确答案
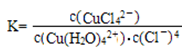
解析
在溶液2转化为CuCl2·xH2O的操作过程中,发现溶液颜色由蓝色变为绿色。在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq) CuCl42-(aq)
蓝色 黄色
上述反应的化学平衡常数表达式是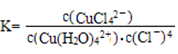
考查方向
制备实验方案的设计
解题思路
化学平衡常数表达式是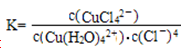
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
正确答案
abc
解析
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是:
a.将Y稀释,平衡向逆反应方向移动,溶液呈蓝色,正确;
b.在Y中加入CuCl2晶体,氯离子浓度增大,平衡向正反应方向移动,溶液变为绿色,正确;
c.在Y中加入NaCl固体,氯离子浓度增大,平衡向正反应方向移动,溶液变为绿色,正确;
d.取Y进行电解,氯离子失去电子,生成氯气,铜离子得到电子,生成金属铜,溶液颜色最终消失,与平衡移动无关,错误;
故选abc;
考查方向
解题思路
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是:
a.将Y稀释,平衡向逆反应方向移动,溶液呈蓝色;
b.在Y中加入CuCl2晶体,氯离子浓度增大,平衡向正反应方向移动,溶液变为绿色;
c.在Y中加入NaCl固体,氯离子浓度增大,平衡向正反应方向移动,溶液变为绿色;
d.取Y进行电解,氯离子失去电子,生成氯气,铜离子得到电子,生成金属铜,溶液颜色最终消失,与平衡移动无关;
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
正确答案
解析
CuCl2•xH2O晶体加热容易分解,且氯化铜易水解,应在HCl气流中低温烘干,故选D。
考查方向
解题思路
CuCl2•xH2O晶体加热容易分解,且氯化铜易水解,应在HCl气流中低温烘干。
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
正确答案

解析
氢氧化铜加热分解所得黑色固体的质量ng为CuO,根据Cu元素守恒:n(CuCl2•xH2O)=n(CuO)=
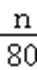

考查方向
解题思路
氢氧化铜加热分解所得黑色固体的质量ng为CuO,根据Cu元素守恒计算;
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
有关下列物质说法正确的是( )
正确答案
解析
略
知识点
扫码查看完整答案与解析