- 金属及其化合物
- 共561题
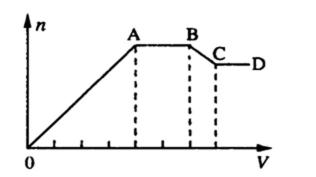
某溶液中,可能含有下表所列离子中的某几种: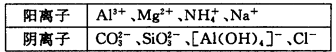
21.若X是NaOH溶液,原溶液中一定含有的阴离子有_________________;BC段反应的离子方程式为______________。
22.若X是盐酸,则原溶液中一定含有的金属阳离子是____________;AB段发生反应的总离子方程式为____________;OA段生成沉淀的物质的量之比为________________。
正确答案
Cl- Al(OH)3+OH-=[Al(OH)4] -或Al(OH)3+OH- = AlO2+ H2O
解析
加入盐酸后能形成的沉淀有Al(OH)3、H2SiO3,前者能溶于过量盐酸而后者不能,由图像知溶液中肯定含有AlO2-、SiO32-,Oa段发生反应的离子为AlO2-、SiO32-,ab段发生反应的离子为CO32-,bc段则是Al(OH)3溶解。当向溶液中加入NaOH溶液时,生成的沉淀为Mg(OH)2、Al(OH)3,ab段是NH4+与OH-发生反应,因Mg2+、Al3+不能与CO32-、SiO32-、AlO2-共存,故此时溶液中的阴离子只有Cl-。
考查方向
解题思路
根据离子反应发生条件以及沉淀生成的顺序,熟练应用元素及其化合物的性质。
易错点
离子反应发生条件
正确答案
Na+ CO32-+2H+=H2O+CO2↑ n(H2SiO3)∶n[Al(OH)3]= 11∶2
解析
加入盐酸后能形成的沉淀有Al(OH)3、H2SiO3,前者能溶于过量盐酸而后者不能,由图像知溶液中肯定含有AlO2-、SiO32-,Oa段发生反应的离子为AlO2-、SiO32-,ab段发生反应的离子为CO32-,bc段则是Al(OH)3溶解。当向溶液中加入NaOH溶液时,生成的沉淀为Mg(OH)2、Al(OH)3,ab段是NH4+与OH-发生反应,因Mg2+、Al3+不能与CO32-、SiO32-、AlO2-共存,故此时溶液中的阴离子只有Cl-。
考查方向
解题思路
根据离子反应发生条件以及沉淀生成的顺序,熟练应用元素及其化合物的性质。
易错点
离子反应发生条件
6.钨酸盐多用作功能材料,也可用作陶瓷材料、催化剂、颜料、防腐剂和防火剂等。在新材料制造中有重要应用,GeWO4的制备方法如下:2GeO (g) +W2O6 (g) 
正确答案
解析
A.△G=△H-T△S,△S<0,温度越高,△G越大,不利于反应的自发进行,A错误;
B.增加GeO的量,其转化率降低,B错误;
C.实际生产中为提高经济效益要尽可能地升高反应温度,加快化学反应速率,C错误;
D.当GeO (g)的消耗速率与 GeWO4 (g)的消耗速率相等时,正逆化学反应速率相等,反应到达平衡,D正确。
故选D。
考查方向
解题思路
A.△G=△H-T△S,△S<0,温度越高,△G越大;
B.增加GeO的量,其转化率降低;
C.实际生产中为提高经济效益要尽可能地升高反应温度,加快化学反应速率;
D.正逆化学反应速率相等,反应到达平衡。
易错点
本题考查了影响平衡移动的因素,注意利用勒夏特列原理分析,题目难度不大。
知识点
不属于国际上可自由兑换货币的是( )。
A.(A) 瑞士法郎
B.(B) 港币
C.(C) 越南盾
D.(D) 加拿大元
正确答案
C
解析
暂无解析
下列解释实验事实的方程式不准确的是
正确答案
解析
略
知识点
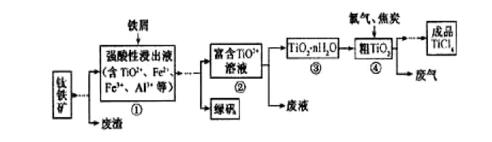
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下:
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生。
2Fe3++Fe=3Fe2+
2TiO2+(无色) +Fe+4H+=2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O=TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________。
(2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在_______范围。
(3)若把③中制得的固体TiO2·n H2O用酸清洗除去其中的Fe (OH)3杂质,还可制得钛白粉。已知25℃时,Ksp[Fe(OH)3]=2.79×10-39,该温度下反应Fe (OH)3+3H+
(4)已知:TiO2 (s) +2 Cl2 (g)=TiCl4(l) +O2(g) △H=+140KJ·mol-1
2C(s) +O2(g)=2CO(g) △H=-221KJ·mol-1
写出④中TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:_____________。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________(只要求写出一项)。
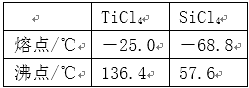
(6)依据右表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。
正确答案
见解析。
解析
(1)根据题意给出方程式分析铁屑的作用就是作为还原剂的,即:将Fe3+还原为Fe2+,另外浸出液显紫色,说明含有Ti3+,防止Ti3+被Fe3+氧化成TiO2+。参考答案中“生成Ti3+保护Fe2+不被氧化。”有点让人费解,能不能说成“防止Ti3+被Fe3+氧化成TiO2+”或者说“将TiO2+还原成Ti3+”。
(2)形成TiO2·n H2O溶胶,说明得到胶体,其分散质颗粒直径大小为10-9~10- 7m(或1nm—100nm);
(3)Ksp[Fe(OH)3]=c(Fe3+)×c3(OH—)=2.79×10—39,25℃时,c(H+)×c(OH—)=Kw=1×10—14;反应Fe (OH)3+3H+
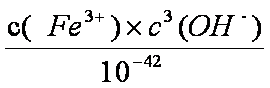

(4)涉及盖斯定律计算,比较常规,按要求写出方程式相加即可得出答案:
TiO2(s)+ 2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g) △H=—81KJ·mol-1
(5)依据绿色化学理念,该工艺流程中存在的不足之处产生了废气,废液,废渣等。
(6)右表信息可以看出,SiCl4,TiCl4两者的沸点相差较大,要精制含少量SiCl4杂质的TiCl4可用蒸馏(或分馏)等方法。
知识点
柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3=== FeCO3↓+Na2SO4 FeCO3+C6H8O7 === FeC6H6O7+CO2↑+H2O 下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
(1)制备FeCO3时,选用的加料方式是 (填字母),原因是 。
a.将FeSO4溶液与Na2CO3 溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。①铁粉的作用是 。②反应结束后,无需过滤,除去过量铁粉的方法是 。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。分离过程中加入无水乙醇的目的是 。
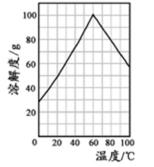
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3 ) 出发,先制备绿矾,再合成柠檬酸亚铁。请结合下图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应, ,得到FeSO4 溶液, ,得到FeSO4·7H2O 晶体。
正确答案
见解析。
解析
(1)c 避免生成Fe(OH)2沉淀
(2)取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净。
(3)①防止+2价的铁元素被氧化 ②加入适量柠檬酸让铁粉反应完全
(4)降低柠檬酸亚铁在水中的溶解量,有利于晶体析出
(5)“(过滤,)向反应液中加入足量的铁粉,充分搅拌后,滴加NaOH溶液调节反应液的pH约为5,过滤”或“过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体中加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,充分搅拌后,过滤”
(滴加稀硫酸酸化,)加热浓缩得到60℃饱和溶液,冷却至0℃结晶,过滤,少量冰水洗涤,低温干燥
知识点
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和漓定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol/L的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中,x值:———(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(C1)=1:2.1,则该洋品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备,FeCl3可用铁粉和__________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________。与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________________,该电池总反应的离子方程式为________________。
正确答案
(1)n(Cl)=0.0250L×0.40 mol∙
(2)10% 盐酸 氯气
(3)
(4)
解析
此题为中档题,前3问这里面就不说了,在计算第一问X值的时候,完全可以把x=2或者x=3代入,这样可以节损时间。第四问也是近几年多次考到的高铁酸钾,有关高铁酸钾的制备与电化学,第四小问考查化学基本功,这里面有很好的区分度,扎实的同学拿满分没问题。第一个方程式多次书写过,第二个方程式,很多同学觉得无法书写,其实首先写大体物质,高铁酸根被还原为Fe3+,然后再写出转移的电子数,根据电荷守衡,因为溶液是碱性的,所以产物只能写成8个OH-,一个Fe3+结合3个OH-生成Fe(OH)3,因为负极反应式为Zn-2e-=Zn2+最后一个方程式只需要综合得失电子守衡就可以得出正确答案。
知识点
下列叙述正确的是
正确答案
解析
本题考查元素化合物的性质、元素周期律的应用等知识,A选项铁与氯气反应时生成FeCl3,与盐酸反应时生成FeCl2;B选项金属钾较活泼能与水反应,生成氢氧化钾而使溶液呈碱性;C选项碱金属元素中,随着原子序数的递增,其对应单质的密度总体趋势是依次增大的,但是钾反常,密度比钠小;根据元素周期律可知,酸性:碳酸<磷酸<硫酸<高氯酸,D选项正确。
知识点
下列金属中,表面自然形成的氧化层能保护内层金属不被空气氧化的是
正确答案
解析
略
知识点
下列有关实验操作、现象和解释或结论都正确的是
正确答案
解析
本题综合考查化学实验以及元素化合物的相关知识。
A选项,铁粉过量应该生成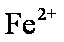
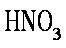
知识点
扫码查看完整答案与解析