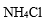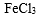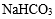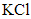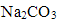- 金属及其化合物
- 共561题
治疗产褥期抑郁症心脾两虚证,应首选()
A.养心汤
B.归脾汤
C.甘麦大枣汤合归脾汤
D.炙甘草汤
E.桂枝加龙骨牡蛎汤
正确答案
C
解析
暂无解析
(NH4)2Fe(SO4)2•6H2O(M=392g•mol-1)又称莫尔盐,简称FAS,其俗名来源于德国化学家莫尔(Karl Friedrich Mohr).它是浅蓝绿色结晶或粉末,对光敏感,在空气中会逐渐风化及氧化,可溶于水,几乎不溶于乙醇.
FAS纯度测定
为测定FAS纯度,取m g样品配制成500 mL溶液,根据物质组成,甲、乙两位同学设计了如下两个实验方
11.甲方案:取20.00 mLFAS溶液,用0.1000 mol·L-1 的酸性K2Cr2O7 溶液进行滴定。i)写出此反应的离子方程式: 。ii) 滴定时必须选用的仪器是 。
12.乙方案:取20.00 mLFAS溶
列出计算FAS晶体纯度的代数式 (不用计算出结果)。
13.
正确答案
i)6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O(2分。化学式错0分。没配平给1分。)
ii)①④⑤⑥(2分。只要有错误即0分)
解析
i).取20.00mLFAS溶液,用0.1000mol•L-1的酸性K2Cr2O7溶液进行滴定,发生的氧化还原反应,亚铁离子被重铬酸钾氧化为铁离子,生成铬离子,反应的离子方程式为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O
ii)酸性K2Cr2O7溶液具有强氧化性,应该使用①酸式滴定管,盛装待测液需要使用④锥形瓶,滴定管需要固定,用到⑤铁架台及⑥铁夹
考查方向
氧化还原滴定
解题思路
i).取20.00mLFAS溶液,用0.1000mol•L-1的酸性K2Cr2O7溶液进行滴定,发生的氧化还原反应,亚铁离子被重铬酸钾氧化为铁离子,生成铬离子
ii).注意是滴定时选用的仪器,不是配制溶液需要仪器,所以应该选用酸式滴定管、锥形瓶、铁架台及铁夹
易错点
氧化还原离子方程式书写
教师点评
本题考查氧化还原滴定,题目难度中等
正确答案
392×25W/2×233m×100% 或196×25W/233m×100%(3分。没加100%不扣分)
解析
取m g样品配制成500mL溶液,取20.00mLFAS溶液进行实验,生成硫酸钡质量为wg,依据定量关系计算,
(NH4)2Fe(SO4)2•6H2O~2SO42-~2BaSO4 ,
1 2
n
解得:
则500ml溶液中为:
FAS晶体纯度的代数式:
考查方向
关系式法定量计算
解题思路
依据定量关系计算,(NH4)2Fe(SO4)2•6H2O~2SO42-~2BaSO4
易错点
关系式
教师点评
本题主要考查关系式法的定量计算,题目难度不大
正确答案
Fe2+被空气部分氧化,(1分)取少量FAS溶液,加入少量KSCN溶液,若溶液变为红色,说明Fe2+已被空气部分氧化(2分。只要有带“.”的关键词即可)
解析
已知实验操作都正确,却发现甲方案的测定结果总是小于乙方案,其可能的原因是Fe2+被空气部分氧化,设计简单的化学实验验证上述推测的实验过程为:取少量FAS溶液,加入少量KSCN溶液,若溶液变为红色,说明Fe2+已被空气部分氧化
考查方向
Fe3+的检验
解题思路
实验操作都正确,却发现甲方案的测定结果总是小于乙方案可能是亚铁离子被空气中氧气氧化,利用铁离子遇到KSCN溶液变红色设计实验检验是否被氧化
易错点
原因分析
教师点评
本题主要考查Fe3+的检验,题目难度不大
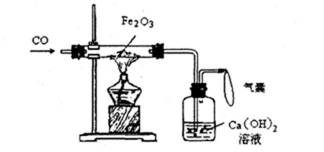
某化学小组利用下图装置完成Fe2O3和CO的反应。
(1)实验开始前,首先必须进行的操作为_______。实验开始时,通入CO气体和加热的先后顺序为_______,点燃酒精灯之前,必须检验装置中排出的CO的纯度。实验过程中,判断反应发生的现象为_______。
(2)实验时可在酒精灯火焰上罩一个金属网罩,该金属网罩的作用是_______。酒精灯对Fe2O3加热温度可达500~600°C,若要提高反应温度,还可选用的加热仪器为_______。
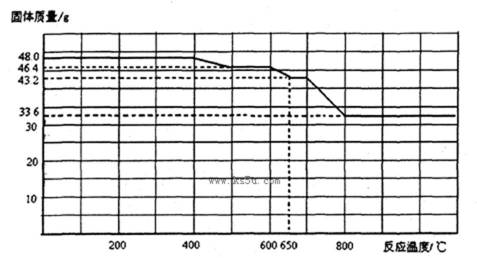
(3)查阅资料知,Fe2O3和CO进行加热反应,固体质量与反应温度的关系如下图所示。
则500~600°C时Fe2O3的还原产物是_______。请设计一个简单实验,证明650~700°C时Fe2O3的还原产物,简述实验操作和现象_______。(可供选择的试剂:稀硫酸、稀盐酸、KMnO4溶液、NaOH溶液、KSCN溶液)
正确答案
(1)检查装置的气密性;先通入CO一段时间,后加热;红棕色粉末逐渐变黑,澄清石灰水变浑浊
(2)提高反应温度,确保受热均匀;酒精喷灯
(3)Fe3O4 ;在适量待检物中加入稀硫酸至完全溶解,再加入少量高锰酸钾溶液,溶液紫色褪去(其他合理答案也给分)
解析
(1)一般来说,凡涉及气体,特别是有毒气体的组装实验装置,实验前都需要检验装置气密性,而对含可燃气体的装置加热时,要确保加热时可燃气体中不含有空气,以防爆炸。
(2)金属网罩可以使火力更加集中,提高加热温度。
(3)CO还原Fe2O3的还原产物可能为Fe3O4,FeO和Fe,根据图中质量变化可知500℃——600℃的还原产物为Fe3O4,650℃——700℃的还原产物为FeO,而800℃以后的还原产物为Fe。要检验FeO,可以利用Fe2+不能与KSCN显色,而被氧化后可与KSCN显色的性质,也可以利用Fe2+能使KmnO4溶液褪色的性质。
知识点
种盐的固体混合物:①加热时有气体产生,②加水溶解时有沉淀生成,且沉淀溶于稀盐酸。满足上述条件的混合物是( )
正确答案
解析
(NH4)2SO3加热时会分解放出气体,BaCl2和(NH4)2SO3溶于水生成的沉淀为BaSO3,它能溶解于盐酸,故A符合题意;B中两种物质溶于水生成的沉淀为AgCl,不能溶解于盐酸,故B不符合题意;C中的NaHCO3 受热会分解放出二氧化碳,FeCl3和NaHCO3 溶于水发生互促水解的反应,生成的Fe(OH)3沉淀溶于盐酸,故C符合题意;KCl和Na2CO3受热都不分解生成气体,故D不符合题意。
知识点
由5mol Fe2O3、4mol Fe3O4和3mol FeO组成的混合物中,加入纯铁lmol并在高温下和 Fe2O3反应。若纯铁完全反应,则反应后混合物中FeO与Fe2O3的物质的量之比可能是
正确答案
解析
略
知识点
等质量的下列物质与足量稀硝酸反应,放出NO物质的量最多是
正确答案
解析
略
知识点
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和

(1)
(2)

(3)配平用钙线氧脱鳞的化学方程式:
P+ FeO+ CaO

(4)将钙线试样溶于稀盐酸后,加入过量


(5)取1.6g钙线试样,与水充分反映,生成224ml.


正确答案
(1)第四周期第ⅡA族,
(2) 
(3)2P+5FeO+3CaO
(4)Fe;Fe+3SCN-=Fe(SCN)3
(5)1.1
解析
本题考查钙、铁的知识。
(1)Ca为20号,位于第四周期,第IIA族。
(2)最活泼的金属为:F, 







(5)








知识点
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和漓定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol/L的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中,x值:———(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(C1)=1:2.1,则该洋品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备,FeCl3可用铁粉和__________反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为________________;
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为________________。与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为________________,该电池总反应的离子方程式为________________。
正确答案
(1)n(Cl)=0.0250L×0.40 mol∙
(2)10% 盐酸 氯气
(3)
(4)
解析
此题为中档题,前3问这里面就不说了,在计算第一问X值的时候,完全可以把x=2或者x=3代入,这样可以节损时间。第四问也是近几年多次考到的高铁酸钾,有关高铁酸钾的制备与电化学,第四小问考查化学基本功,这里面有很好的区分度,扎实的同学拿满分没问题。第一个方程式多次书写过,第二个方程式,很多同学觉得无法书写,其实首先写大体物质,高铁酸根被还原为Fe3+,然后再写出转移的电子数,根据电荷守衡,因为溶液是碱性的,所以产物只能写成8个OH-,一个Fe3+结合3个OH-生成Fe(OH)3,因为负极反应式为Zn-2e-=Zn2+最后一个方程式只需要综合得失电子守衡就可以得出正确答案。
知识点
高铁酸钾( K2FeO4)是一种新型的自来水处理剂,它的性质和作用是
正确答案
解析
高铁酸钾中的铁元素显+6价,具有强氧化性,可消毒杀菌,被还原后生成的+3价的铁离子可发生水解生成氢氧化铁胶体,从而可吸附水中的杂质。
知识点
11.为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的工业原料FeSO4(反应条件略)
活化硫铁矿还原Fe2+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应,请回答下列问题:
(1)第1步H2SO4与Fe2O3反应的离子方程式是( )。
(2)检验第II步中Fe3+是否完全还原,应选择( ) (填字母编号)。
A.KMnO4溶液
B.K2[Fe(CN)4]溶液
C.KSCN溶液
(3)第III步加FeCO3调溶液pH到5.8左右,然后再第VI步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是( )。
(4)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
(5)已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) 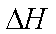
C(s)+O2(g)=CO2(g) 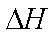
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) 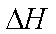
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是( )。
(6)加入烧渣中的铁全部视为Fe2O3,其含量为50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取,铁的浸取率为96%,其他杂质浸出消耗掉饿硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第III步应加入FeCO3 ( )kg。
正确答案
(1)Fe2O3+6H+=2Fe3++3H2O
(2)C
(3)Fe2+被氧化为Fe3+,Fe3+水解产生H+。
(4)4FeCO3(s)+O2(g) =2Fe2O3(s)+ 4CO2(g) 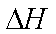
(5)FeS2+4Li++4e-= Fe+2 Li2S或FeS2+4e-= Fe +2S2-
(6)0.0118ab-0.646c或-kg。
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析