- 金属及其化合物
- 共561题
16.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
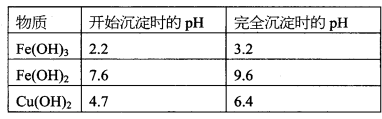
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
回答下列问题:
(1)流程中加入少量NaHCO3的目的是调节pH,使溶液中的___________(填“Fe3+”“Fe2+”或“Al3+”)沉淀,则调节pH的范围是___________________.
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作______。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________。用NaNO2的缺点是产生NO污染,若用双氧水代替NaNO2发生反应的离子方程式是________________________________。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)聚合离子。该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母)。
A. 氯水
B. KSCN溶液
C. NaOH溶液
D. 酸性KMnO4溶液
正确答案
(1)Al3+ 4.4---7.5
(2)氧化剂 2mol Fe2++H2O2+2H+==Fe3++H2O
(3)2Fe(OH)2++2H2O
(4)D
解析
解析已在路上飞奔,马上就到!
知识点
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
已知:3NO3-+ 8Al + 5OH- + 2H2O
根据以上的实验操作与现象,该同学得出的结论不正确的是
正确答案
解析
略
知识点
下列叙述I和II均正确且有因果关系的是
正确答案
解析
略。
知识点
下图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知:
①反应C+G
②I是一种常见的温室气体,它和E可以发生反应:2E+I
为60%。
回答问题:
(1)①中反应的化学方程式为__________;
(2)化合物I的电子式为__________,它的空间结构是__________;
(3)1。6g G溶于盐酸,得到的溶液与铜粉完全反应,计算至少需铜粉的质量(写出粒子方程式和计算过程);
(4)C与过量NaOH溶液反应的离子方程式为__________;
(5)E在I中燃烧观察到的现象是__________。
正确答案
(1)Al+ Fe2O3
(2)
(3)2Fe3++Cu=2 Fe2++ Cu2+ n(Fe2O3)=0.01mol,依据离子方程式,则n(Cu )= 0.01mol,m(Cu )=0.64g。
(4)2 Al + 2OH- + 2 H2O=2AlO2- + 3H2↑ AlO2- + CO2 + 2H2O = Al(OH)3↓+ HCO3-
(5)剧烈燃烧,放出热量,生成黑色固体和白色固体。
解析
该题有多处“题眼”。依据题目信息C、B是单质,G、H是二元化合物,
知识点
已知:Fe5O7可以看作Fe2O3和Fe3O4的混合物。现有Fe、Fe2O3、Fe5O7混合物共0.1 mol,加盐酸后固体全部溶解,共收集到0.01 mol H2,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为
正确答案
解析
略
知识点
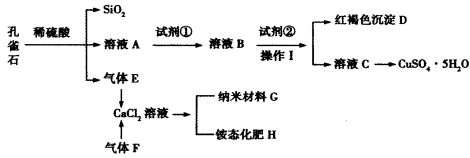
孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O及纳米材料G,主要步骤如下:
已知该条件下,通过调节溶液的酸碱性而使Fe3+、Fe2+、Cu2+沉淀完全。Fe3+、Fe2+、
Cu2+开始沉淀及完全沉淀的pH分别如下:
请回答下列问题:
(1)孔雀石主要成分Cu2(OH)2CO3与稀硫酸反应的化学方程式为_______________。
(2)溶液A的金属离子有Cu2+、Fe2+、Fe3+。要检验其中的Fe2+应选择下列试剂中的___________(填序号)。
a。KMnO4 b。NaOH C。H2O2 d。KSCN
(3)试剂①是一种氧化剂,加入该氧化剂的作用是______________;
(4)向溶液B中加入试剂②的化学式为__________________。
(5)气体E和气体F应该先通入CaCl2溶液中的是_______________(填化学式)。写出制备G和H的化学反应方程式______________。
(6)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中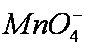
mol/L KMnO4溶液16。00 mL时,恰好达到滴定终点,则A溶液中Fe2+浓度为________。
正确答案
(1)Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑
(2)a
(3)将溶液中的Fe2+氧化为Fe3+(以便在Cu(OH)2沉淀之前,通过调节溶液pH使Fe(OH)3沉淀完全)
(4)CuO或Cu(OH)2或CaCO3 或Cu2(OH)2CO3 (写一种即可,多写且正确不扣分)
(5)NH3 2NH3+CO2+CaCl2+H2O==CaCO3↓+2NH4Cl
(6)MnO4- + 5Fe2+ + 8H+=== Mn2+ + 5Fe3+ + 4H2O 0.0960mol/L
解析
略。
知识点
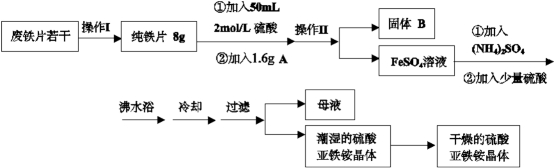
亚铁盐在空气中易被氧化,但是形成复盐可稳定存在。硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O 商品名莫尔盐]是一种重要的化学试剂,实验室用废铁片制取硫酸亚铁铵的流程如下方案一所示:
请回答下列问题:
(1)操作I主要包括除油、除杂、过滤、烘干、称量等过程,其中除油污需要的最佳试剂
(填序号)
a. H2O
b. 3 mol·L-1 H2SO4
c.热的 10%的Na2CO3溶液
(2)若A物质为CuSO4 ,其加入的目的是 ,则固体B的成分为 。
(3)操作II的名称是 ,所用主要玻璃仪器有:烧杯、
(4)加入少量硫酸可以调节pH为1~2,其作用是 (结合化学用语
和简要语言说明)。
(5)选用下列提供的试剂,设计实验验证硫酸亚铁铵晶体中含有Fe2+离子,而不含Fe3+。
提供的试剂:稀硫酸, KSCN溶液,新配制的氯水,NaOH溶液
检验方法:
(6)在此流程中,理论上得到硫酸亚铁铵晶体 g(精确到小数点后两位)
相关物质的摩尔质量如下,单位g/mol,(NH4)2SO4:132; FeSO4:152; H2O:18
(7)该流程图中的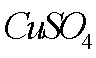
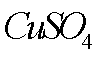
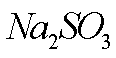
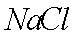
正确答案
见解析。
解析
(1) c
(2)形成微小原电池,加快铁与硫酸反应速率。
铁(Fe)和铜(Cu)
(3)过滤 漏斗、玻璃棒
(4)Fe 2++2H2O

加入硫酸保持酸性,抑制Fe 2+ 、NH4+离子的水解,得到更多的产品
(5)39.2
(6)2Cu2++SO32-+2Cl-+H2O
知识点
28.某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物。
(1)组装好仪器后必须进行的操作是( ),用2%的

(2)为快速得到乙醇气体,可采取的方法是( ) 。
(3)如图实验,观察到红色的
(4)为了检验M的组成,进行下列实验。
① M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
② 经检验溶液中有铁离子和亚铁离子,检验铁离子的方法是( ); 能得出的结论是( ) (填写编号)。
a.M中一定有+3价和+2价铁,无0价铁 b.M中一定有+3价和0价铁,无+2价铁
c.M中一定有+3价,0价和+2价铁至少有一种 d.M中一定有+3价、+2价和0价铁
(5)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成。称取m g M样品进行定量测定,实验装置和步骤如下:
① 组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧……。正确的操作顺序是( )(填写编号)
a.①⑤④③②⑥⑦⑧ b.①⑤③④②⑥⑦⑧
c.①③⑤④②⑦⑥⑧ d.①③⑤②④⑥⑦⑧
(6)若实验中每步反应都进行完全,反应后M样品质量减少了n g,则FeXOY中
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
相关信息:①四氯化硅遇水极易水解;②SiCl4沸点为57.7℃,熔点为-70.0℃。请回答:
(1)写出装置A中发生反应的离子方程式( )。
(2)装置C中的试剂是( );装置F的作用是( );装置E中的h瓶需要冷却的理由是( )。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
①反应的离子方程式:( )。
②滴定前是否要滴加指示剂?( )(填“是”或“否”),请说明理由( )。
③滴定前检验Fe3+是否被完全还原的实验操作是 ( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28. 某校化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数,并探究铁与浓硫酸的反应。
(1)m克铁碳合金中加入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是
①常温下碳与浓硫酸不反应;② ___________________ 。
(2)写出加热时A中碳与浓硫酸发生反应的化学方程式 ______________________ 。
(3)B中的现象是: _______________________________________ ;C的作用是: ___________________。
(4)待A中不再逸出气体时,停止加热,拆下E并称重,E增重bg。则铁碳合金中铁的质量分数为 _____________ (写表达式)。
(5)反应一段时间后,用滴管吸取A中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ: ________________ 。
验证Ⅲ的实验方法是 ___________________ 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析