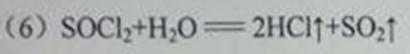- 化学用语
- 共784题
11.把氢氧化钙放入蒸馏水中,一定时间后可达到平衡:

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:①NH4HCO3、②NH4Cl、③Ca(OH)2、④NaOH。
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯,铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是_________________(填代表备选试剂的序号);此时A中主要的玻璃仪器有________________________(填名称)。
(2)下面关于A中所用试剂的说法正确的是___________________。
(3)装置C中发生催化氧化反应的化学方程式为___________________________,装置E发生反应的化学方程式为__________________________________________。
(4)假设A、B中的药品充足,则装置F中可以观察到的现象有________________________
_____________________________________________________________________。
(5)指导老师从安全与环保角度考虑,指出该装置有两处明显的缺陷,请你提出修改建议:________________________________________________________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.(Ⅰ)某无色稀溶液X中,可能含有下表所列离子中的某几种。
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y体积(V)的关系如图所示。
(1)若Y是盐酸,则溶液中含有的金属阳离子是________,ab段发生反应的总离子方程式为__________,Oa段上表中参加反应的离子的物质的量之比为:_______________[要标明离子符号,如n(Na+)]。
(2)若Y是NaOH溶液,则bc段反应的离子方程式为______。若不考虑离子的水解因素,忽略H+和OH—影响,且溶液中只存在四种离子,则它们的离子个数比为 _____________[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列]。
(Ⅱ)锡为第IVA族元素,锡的单质和化合物与某些物质的化学性质上有许多相似之处。已知锡元素具有如下性质:①Sn4++Sn====2Sn2+;②2Sn2++O2+4H+====2Sn4++2H2O;
③2H++SnO

(1)锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的化学方程式:___________,__________。
(2)将(1)中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(分子式) ____________ 。
(3)若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2, 该碱是__________。
正确答案
(Ⅰ)(1)Na+ ;CO32-+2H+=H2O+CO2↑ n(SiO32-):n (AlO2-)=11:2
(2)Al(OH)3+OH-=AlO2-+2H2O N(Al3+):N(Mg2+):N(NH4+):N(Cl-)=2:1:4:12
(Ⅱ)(1)Sn+2HCl=SnCl2+H2↑ SnCl2+Cl2=SnCl4
(2)SnO2 (3) NH3·H2O
解析
解析已在路上飞奔,马上就到!
知识点
27.
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.下列离子方程式或化学方程式书写正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.有一含NaCl、

(1)实验时,B中发生反应的化学方程式为( ) 。
(2)装置C、D中盛放的试剂分别为:C( ),D ( )(供选试剂为:浓硫酸、无水CaCl2、碱石灰)。
(3)E装置中的仪器名称是( ),它在该实验中的主要作用是( )。
(4)若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将 ( )(填“偏高”、“偏低”或“无影响”)。
(5)加热前,向B装置中通入空气可减少实验误差,操作方法是( )。
(6)若样品的质量为mg,反应后C、D的质量差分别为m1g、m2g,则该混合物中
正确答案
(1)
(2)无水
(3)(球形)干燥管(1分) ; 防止空气中的
(4)偏低
(5)关闭b,打开a,将空气缓慢鼓入
(6)
解析
解析已在路上飞奔,马上就到!
知识点
28.为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和下图所示的实验装置进行实验。请回答下列有关问题:
(1)若某种固体物质受热发生了分解,下列说法正确的是( )
A.充分加热后一定有固体残留
B.加热前后固体颜色一定无变化
C.加热前后固体质量一定有变化
D.一定生成了新的物质E.充分加热后得到的残留固体一定为混合物
(2)查阅资料:无水亚硫酸钠隔绝空气受热到
(3)如果加热温度为
(4)在(3)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X)。为检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可采取( )的措施。以下是检验阴离子(X)的两种实验方案,你认为合理的方案是( )(填“甲”或“乙”),请说明另一方案不合理的原因( )。
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在。
(5)写出Na2SO3固体加热到600℃以上分解的化学方程式( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
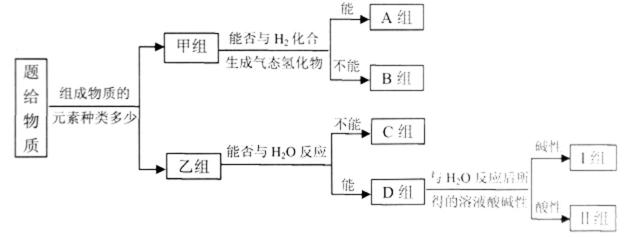
26.现有 NH3、CO、Na、Na202、Fe、NO、NO2, F2、SO2.SOCl2 等中学化学教材中出现过的物质,根据它们的组成及性质进行如下分类
请回答下列问题
(1)图中所示的分类方法叫_______________
(2)淡黄色固体最终位于_______组,它的电子式为_______。
(3)C组有一种气体常用作工业上冶炼铁的还原剂,写出高温下它还原Fe2O3的化学方程式_________。
(4)写出II组的某种物质与水发生氧化还原反应的离子方程式__________。
(5)B组中有一种物质在高温下能与水蒸气反应,若该反应过程中有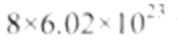
(6)II组另有一种物质滴入水中后与水激烈反应,液面上有酸雾形成,并有能使品红溶液褪色的气体逸出,该反应的化学方程式为______________
正确答案


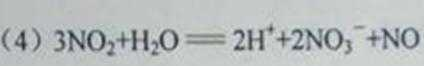
解析
解析已在路上飞奔,马上就到!
知识点
24.某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿制取活性ZnO的方案,实现废物综合利用,方案如下图所示
已知:298K时各离子开始沉淀及完全沉淀时的pH如下表所示。
请回答下列问题:
(1)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS
不溶,这是由于相同温度下:Ksp(CuS) ( ) Ksp(ZnS)(选填“>”“<”或“=”)。
(2)你认为在除铁过程中选用下列物质中的( )(填序号)作为试剂甲是最合适的。
A.KMnO4 B.O2 C.H2O2 D.Cl2
(3)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在( )范围之间。
(4)请写出加甲物质后,加入氨水控制调节溶液的pH下生成Fe(OH)3反应的离子方
程式( )。
(5)298K时,残留在溶液中的c(Fe3+)在( )。以下。
(6)乙的溶液可直接用作氮肥,则乙的化学式是( ) 。
(7)请写出“沉淀Zn2+”步骤中发生反应的化学方程式 ( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
25.某同学想通过利用下图所示装置(夹持装置已略去)实验,探究SO2与Na2O2反应的产物
实验后测得反应前C管的质量为m1 g,反应后C管的质量为m 2 g,反应后装置D质量增加了n g。请分析:
Ⅰ.装置B的作用 ( )。
装置D的作用 ( ) 。
Ⅱ.如何检验反应中是否有O2生成 ( )。
Ⅲ.对C中固体产物提出如下假设:
假设1:只有Na2SO3
假设2:只有Na2SO4
假设3: ( ) 。
(1)若按假设2进行,反应方程式为 ( ) 。
(2)若Na2O2反应完全,为确定C中固体产物的成分,甲同学设计如下实验:
得出结论:产物是Na2SO4。
该方案是否合理( )(填“是”或“否”),理由是( )。
(3)若假设1成立,某同学以反应前后C管的质量差( m 2 - m 1 )g为依据推断生成Na2SO3的质量为( m 2 - m 1 )×126/64 g。老师提示推算不合理,请你分析其中的缘由: ( ).
(4)若假设2成立,则参加反应的Na2O2 物质的量为( )(列计算式)摩尔。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析