- 化学用语
- 共784题
29.某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H5OH ②有关有机物的沸点:
请回答:
⑴ 浓硫酸的作用是( ▲ );仪器A的名称是( ▲ );若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式( ▲ )

⑶ 待实验结束后,观察发现装置B中溶液变成了棕黑色,试用化学方程式解释其原因:( ▲ ) 。
⑷ 从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和少量水,应先加入无水氯化钙,分离出乙醇;然后在混合液中加入沸石,再加热进行蒸馏,收集( ▲ )左右的馏分,以得较纯净的乙酸乙酯。
正确答案
⑴ 制乙酸、催化剂、吸水剂;分液漏斗 化学方程式略
⑵ 防止倒吸; 2 CH3COOH + CO32- =2CH3COO-+ CO2 +H2O
⑶ C2H5OH+2H2SO4→2C+2SO2+5H2O;
⑷ 77.1℃
解析
解析已在路上飞奔,马上就到!
知识点
24.某学习小组利用某工业废弃固体(主要成分为Cu2S和_Fe2O3)来研究相关物质的制备。设计方案如图所示:
(1)废弃固体在空气中灼烧,发生反应的化学方程式为_______________。
(2)溶液C通过_________、_________、过滤等操作得到Fe2(SO4)3晶体。
(3)常温下,铜粉、O2和稀硫酸三者在一起生成硫酸铜反应极慢。当往其中加入溶液B后,
随即生成硫酸铜。这一过程中反应的化学方程式依次为:
(4)操作⑧的目的是制取较纯的硫酸铜溶液。溶液E中加入试剂Y以调节pH使得铁元素沉淀完全(含铁元素的离子浓度小于10-5mol·L-1)。试剂Y可以是____________,调节溶液的pH不小于____________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
25.铝镁合金已成为轮船制造.化工生产等行业的重要材料。研究性学习小组的三位同学,为测定已知质量的铝镁合金(设不含其它元素)中镁的质量分数,设计下列三种不同实验方案(所加试剂均为足量)进行探究。填写下列空白。
[探究一]
实验方案:铝镁合金

问题讨论:
(1)某同学提出该实验装置不够完善,应在A.B之间添加一个装有碱石灰的干燥装置。你的意见是:________ (填“需要”或“不需要”)。
(2)为准确测定生成气体的体积,实验中应注意的问题是(只要求写出其中一点):( )
[探究二]
实验方案:铝镁合金
问题讨论:
(1)称取一定质量的铝镁合金粉末样品,加入过量的NaOH溶液,充分反应。实验中发生反应的化学方程式是 ( )。
(2)过滤.洗涤.干燥.称量剩余固体。若未洗涤固体,测得镁的质量分数将_____(填 “偏高”或“偏低”)。
[探究三]
实验方案:铝镁合金 

问题讨论:
(1)甲同学认为该方案不可行,试说明理由:( ) 。
(2)乙同学认为只要调整所加试剂的顺序,就可以达到实验目的,如果他的看法正确,
则所得的沉淀是 ( )。
(3)丙同学认为也可以通过用足量A物质代替盐酸来达到实验目的,则A物质可以是( ),请写出对应反应的化学方程式: ( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解。某小组模拟制备氨基甲酸铵,反应如下(且温度对反应的影响比较灵敏):2NH3(g)+CO2(g)
(1)如用下图I装置制取氨气,可选择的试剂是 。
(2)制备氨基甲酸铵的装置如下图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中。 当悬浮物较多时,停止制备。
注:CCl4与液体石蜡均为惰性介质。
①发生器用冰水冷却的原因是_________________________________________,液体石蜡鼓泡瓶的作用是 ( ) 。
②从反应后的混合物中分离出产品的实验方法是( )(填写操作名称)。为了得到干燥产品,应采取的方法是________(填写选项序号)。
a.常压加热烘干 b.高压加热烘干 c.减压40℃以下烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种。
①设计方案,进行成分探究,请填写表中空格。
限选试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、稀盐酸。
②根据①的结论:取氨基甲酸铵样品3.95 g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为1.97 g。则样品中氨基甲酸铵的物质的量分数为_______________。[Mr(NH2COONH4)=78、Mr(NH4HCO3) =79、Mr(BaCO3)=197]
正确答案
(1)浓氨水与氢氧化钠固体等合理答案
(2)①降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解);
通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率)
②过滤 c
(3)①
②0.800或80.0%(有效数字没有考虑不扣分)
解析
解析已在路上飞奔,马上就到!
知识点
7. 下列反应式的表达中,正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,下图是制取并探究Cl2化学性质的装置图。
(1)写出圆底烧瓶中反应的化学方程式( ) 。
(2)A中m管的作用是( );装置F的作用是( ) 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是( ) ,C中应盛放的试剂是( ) 。
(4)E中若装有FeCl2溶液,反应的离子方程式为( );E中若装有淀粉碘化钾溶液,能观察到的实验现象是 ( ) 。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通人HCl气体,加热
b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是 ( );实验c的目的是 ( ) 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 ( )。
29.二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,下图是制取并探究Cl2化学性质的装置图。
(1)写出圆底烧瓶中反应的化学方程式 。
(2)A中m管的作用是 ;装置F的作用是 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是 ,C中应盛放的试剂是 。
(4)E中若装有FeCl2溶液,反应的离子方程式为 ;E中若装有淀粉碘化钾溶液,能观察到的实验现象是 。
(5)实验中发现:浓盐酸与MnO2混合加热生成氯气,稀盐酸与MnO2混合加热不生成氯气。针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通人HCl气体,加热
b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.MnO2与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是 ;实验c的目的是 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 。
正确答案
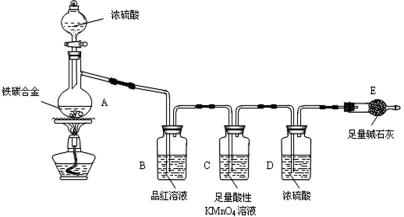
28.现有某铁碳合金(铁和碳两种单质的混合物),某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的某些性质,设计了下图所示的实验装置(夹持仪器已省略)和实验方案进行实验探究。
I 测定铁的质量分数:
(1)检查上述装置气密性的一种方法是:关闭分液漏斗的活塞,在E装置后面连上一根导管,然后__________________________________,则证明装置的气密性良好。
(2)称量E的质量,并将a g铁碳合金样品放入装置A中,再加入足量的浓硫酸,待A中不再逸出气体时,停止加热,拆下E并称重,E增重b g。铁碳合金中铁的质量分数为__________________________(写表达式)。
(3)装置C的作用______________________________________________。
(4)甲同学认为,依据此实验测得的数据,计算合金中铁的质量分数可能会偏低,原因是___________________________________________________________。
(5)乙同学按照甲同学认为改进实验,改进方法是______________但测得合金中铁的质量分数却偏高。你认为其中可能的原因是_________________。
Ⅱ 探究浓硫酸的某些性质:
(6)往A中滴加足量的浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:________________________________________________。
(7)A中铁与浓硫酸发生反应的化学方程式是_______________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.(14分)1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4 ℃,熔点9.79 ℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水) 。
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式:
__________________________________________________________,
___________________________________________________________。
(2)配制乙醇和浓硫酸混合液的要求和操作要点( )。
(3)反应后期a中反应物混合液的颜色逐渐变黑,请用简要文字和化学方程式说明原因____________________________________________________________________________。
(4)瓶b的作用为:____________________________________________________________。
(5)容器c、e中NaOH溶液的作用分别是:________________________________________
____________________________________________。
(6)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多,如果装置的气密性没有问题,试分析其可能的原因:
____________________________________________________________________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
16.(9分)某同学根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧。为了确定其生成产物并进行实验论证,请你参与以下研究过程。该同学按实验要求,用下列装置进行实验(已知PdCl2溶液能被CO还原得到黑色的Pd),请完成下列问题:
(1)装置1中玻璃仪器的名称是 ( ),( );装置2的作用是( )。
(2)若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:( );
(3)若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:( );
(4)指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳,当确认钠充分反应后,请你设计一个简单实验,验证装置4中得到的残留固体中是否含有碳:( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10、能正确表示下列化学反应的离子方程式或化学方程式的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析