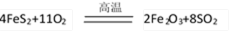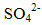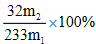- 化学用语
- 共784题
Na2SO3是抗氧剂。向烧碱和Na2SO3的混合溶液中加入少许溴水,振荡溶液变为
无色。
(1)SO2是大气污染物,是形成 的因素之一,实验室用亚硫酸钠固体与一定浓度的硫酸溶液反应制备SO2气体,写出该反应的化学反应方程式 。
尾气通入过量NaOH溶液可得到烧碱和Na2SO3的混合溶液,该反应的离子反应方程式为 。
(2)碱性条件下Br2与Na2SO3溶液反应的离子方程式为 。
(3)硅酸钠溶液俗称水玻璃。取少量硅酸钠溶液于试管中,通入过量的SO2,得到沉淀物。写出该反应的离子方程式: 。
(4)CO2气体中含有少量SO2气体,要除去SO2杂质,将混合气体通入 试剂,其
反应的离子方程式: 。
(5)为了探究氨还原性,某研究小组用氨和CuO在加热条件下反应,产物中得到一种红色
固体和一种气体单质。写出反应化学方程式 。
正确答案
(1)酸雨(2分) SO32- + 2H+ = SO2↑+ H2O (2分)
SO2 + 2NaOH = Na2SO3 + H2O (2分)
(2)Br2 + SO32- + 2OH- = 2Br- + SO42- + H2O (2分)
(3)SiO32- + 2SO2 + 2H2O = H2SiO3↓ + 2HSO3- (2分)
(4)3CuO + 2NH3
(5)饱和碳酸氢钠溶液 (2分) HCO3- + SO2 = HSO32- + CO2(2分)
解析
略
知识点
某化学兴趣小组用只含有铝、铁、铜的工业废料制取纯净的氯化铝溶液、绿

(1)写出合金与烧碱溶液反应的离子方程式: 。
(2)由滤液A制Al
(3)滤液E若放置在空气中一段时间后,溶液中的阳离子除了

(用离子符号表示),检测该离子的方法是 。
(4)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是: 。
(5)途径④发生的反应的化学方程式为: 。
(6)实验室从CuSO4溶液制取胆矾,操作步骤有蒸发浓缩、冷却结晶、 、自然干燥。
正确答案
(1)2Al +2OH― + 2H2O → 2AlO2― +3H2↑
(2)
(3)Fe3+ 取样,滴加KSCN,若变血红色,则有Fe3+ 。
(4)成本低 ;不产生有毒气体
(5)2Cu +2H2SO4 +O2 → 2CuSO4 +2H2O
(6)过滤洗涤
解析
略
知识点
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是
正确答案
解析
略
知识点
下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是
①碳酸钠溶液与盐酸 ②偏铝酸钠溶液与盐酸 ③二氧化碳与氢氧化钠溶液
④硝酸银溶液和氨水 ⑤氯化铝与氨水 ⑥碳酸氢钠溶液与澄清石灰水
正确答案
解析
略
知识点
下列有关反应的离子方程式正确的是
正确答案
解析
略
知识点
解释下列事实的方程式正确的是
正确答案
解析
略
知识点
在硫酸酸化的碘化钾溶液里加入过量的过氧化氢溶液,不久就有无色小气泡从溶液中逸出,且溶液呈棕色,下列叙述中错误的是( )
正确答案
解析
略
知识点
向碳酸氢镁溶液中逐滴加入澄清石灰水,下列离子反应可能发生的是:
正确答案
解析
略
知识点
黄铁矿石的主要成分为FeS2和少量FeS(假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。
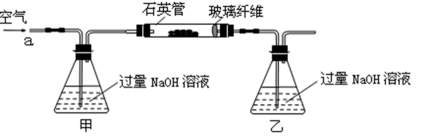
将m 1 g该黄铁矿石的样品放入如下图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为:
【实验一】:测定硫元素的含量
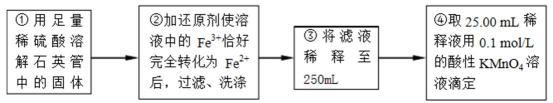
反应结束后,将乙瓶中的溶液进行如下处理:
(1)甲、乙两装置的作用分别是_______、_______;
乙瓶内发生反应的离子方程式为_______、_______;
(2)反应后乙瓶中的溶液需加足量H2O2溶液的目的是_______。
(3)该黄铁矿石中硫元素的质量分数为_______。
【实验二】:测定铁元素的含量
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量_______(填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_______。
(6)某同学一共进行了三次滴定实验,三次实验结果记录如下:
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+) =_______。
正确答案
见解析。
解析
(1)除去空气中的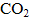
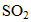
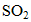
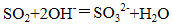
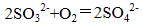
(2)使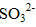
(3)
(4)偏大
(5)250mL容量瓶
(6)0.5mol/L
知识点
卤素单质及其化合物在生产和生活中有广泛应用。
Ⅰ、氟化钠主要用作农作物杀菌剂、杀虫剂、木材防腐剂。实验室以氟硅酸(
已知:20℃时氯化铵的溶解度为37.2 g,氟化钠的溶解度为4 g,Na2SiF6微溶于水。
请回答下列有关问题:
(1)完成并配平上述流程中①、②的化学反应方程式:
② 。
(2)操作Ⅲ分为两步,其顺序是 (填写所选序号)。
a、过滤 b、加热浓缩 c、冷却结晶 d、洗涤
操作Ⅱ是洗涤、干燥,其目的是 ,在操作Ⅰ~V中与之相同的操作步骤是 。
(3)流程①中NH4HCO3必须过量,其原因是 。
Ⅱ、紫菜与海带类似,是一种富含生物碘的海洋植物,可用于食用补碘。以下为某兴趣小组模拟从紫菜中提取碘的过程:
已知:商品紫菜轻薄松脆,比海带更易被焙烧成灰(此时碘转化为碘化物无机盐)。
(4)将焙烧所得的紫菜灰与足量的双氧水和稀硫酸作用,写出反应的离子方程式:
。
(5)操作①中涉及两步操作,名称是 ,所用的主要玻璃仪器为 ,所用试剂A最好选用表格中的 (填试剂名称)。
(6)将下列装置图中缺少的必要仪器补画出来,以最终将单质碘与试剂A分离:
正确答案
(1)
(2)be(1分) ; 除去氟化钠表面的氯化铵等可溶性杂质(1分) ; V(1分)
(3)使氟硅酸完全反应,避免析出Na2SiFe而混入杂质(1分)
(4)
(5)过滤;烧杯;碘
(6)
解析
略
知识点
扫码查看完整答案与解析