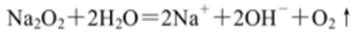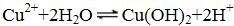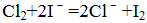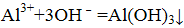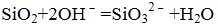- 化学用语
- 共784题
下列说法中正确的是
正确答案
解析
略。
知识点
以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(
(1)氧化过程中发生反应的离子方程式是_________,检验氧化生成的阳离子的试剂是_________。
(2)尾气中主要含

方案一:让尾气缓慢通过以下装置。
①C仪器的名称是_________,该装置的作用是_________。
②实验时先通入尾气,再通入一定量氮气。若通过B装置的增重来测量SO2的体积分数。你认为该方案是否合理_________,请说明理由_________(若方案合理该空不必填写)。
方案二:将尾气缓慢通过足量溴水,在所得的溶液中加入过量氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为mg。
①加入过量氯化钡溶液的目的是_________。
②进行沉淀洗涤的方法是_________。
③SO2含量的表达式是_________(用含m、V的代数式表示)。
(3)从FeCl3溶液中得到FeCl3·6H2O晶体的操作包括_________、冷却结晶、过滤,该过程需保持盐酸过量,结合必要的离子方程式说明原因_________。
正确答案
(1)2Fe2+ + Cl2= 2Cl- + 2Fe3+;KSCN溶液
(2)方案一:①干燥管;防止空气中的水蒸气、CO2被B装置吸收;②否;尾气中的CO2也能被B装置吸收使所测质量分数偏大;方案二:①使生成的SO42-完全转化为沉淀;②在漏斗中加蒸馏水至恰好没过沉淀,待水流下后再重复2~3次此操作;③
(3)蒸发浓缩;Fe3+ + 3H2O 
解析
略。
知识点
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
(1)B中反应的离子方程式是______。
(2)A中溶液变红的原因是______。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_______。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为 
①甲同学认为SCN—中碳元素没有被氧化,理由是______。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是______。
③通过实验证明了SCN—中氮元素转化为,他的实验方案是______。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是______mol。
正确答案
见解析。
解析
(1)Cl2+2OH— === Cl—+ClO—+ H2O
(2)Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN—反应生成红色的,所以溶液变红
(3)①Fe3+
(4)①SCN—中的碳元素是最高价态+4价
②硫元素
③取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN—中氮元素被氧化成
④16
知识点
利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。
请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作所用的玻璃仪器是____ 。
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、______________________________。
(2)步骤④的离子方程式是 ___________________________________ 。
(3)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及 _______ 。
(4)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为 ______ 。
(5)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因 _______ 。
(6)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol•L-1 KMnO4溶液20.00 mL,所得晶体中FeSO4·7H2O的质量分数为(用a表示) —————————— 。
正确答案
(1)玻璃棒、漏斗、烧杯 降温结晶
(2)Fe2++2HCO3—→FeCO3↓+H2O+CO2↑
(3)防止Fe2+被氧化
(4)1: 4
(5)FeCO3(s) 
(6)13.9/a
解析
略
知识点
下列叙述正确的是
正确答案
解析
略
知识点
下列离子方程式不正确的是
正确答案
解析
略
知识点
金属钛(Ti)性能优越,被称为继铁、铝之后的“第三金属”。工业上以钛铁矿(主要成分FeTiO3,含FeO、Al2O3、SiO2等杂质)为主要原料冶炼金属钛,其生产的工艺流程图如下:
已知:2H2SO4(浓)+ FeTiO3=TiOSO4 + FeSO4 + 2H2O
(1)步骤I中发生反应的离子方程式: 、 。
(2)已知:TiO2+易水解,只能存在于强酸性溶液中。25 ℃时,难溶电解质溶解度与pH关系如右图,TiO(OH)2溶度积Ksp=1×10-29
①步骤Ⅲ加入铁屑原因是 。
② TiO2+水解的离子方程式为 。
向溶液II中加入Na2CO3粉末的作用是 。
当溶液pH= 时,TiO(OH)2已沉淀完全。
(3)TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
(4)电解TiO2制备钛的方法如右图所示。该方法由于具备生产过程简化、生产成本低、产品质量高、环境友好等诸多优点而引人注目。已知TiO2熔融状态下不发生电离,电解时阴极反应式为 。
正确答案
(1)Al2O3+2OH-=2AlO2-+H2O(或Al2O3+2OH-+3H2O=2[Al(OH)4]-);SiO2+2OH-=SiO32-+H2O
(2)①将Fe3+转化为Fe2+,防止Fe3+与TiO2+同时生成沉淀
②TiO2++2H2O
(3)1412
(4)TiO2+4e-=Ti+2O2-
解析
略
知识点
下列解释事实的离子方程式不正确的是
正确答案
解析
略
知识点
能正确表示下列各组溶液混合后,所得液体恰好呈中性的离子方程式是
正确答案
解析
略
知识点
能正确表示下列各组溶液混合后,所得液体恰好呈中性的离子方程式是
正确答案
解析
略
知识点
扫码查看完整答案与解析