- 化学用语
- 共784题
空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。
(1)NaBr的电子式是 。
(2)反应①是将Br—转化为Br2,反应①的离子方程式是 。
(3)通入空气吹出Br2,并用Na2CO3吸收的目的是 。
(4)反应②的化学方程式是 。
(5)反应③中每生成3 mol Br2,转移电子的物质的量是 mol。
(6)为了除去工业Br2中微量的Cl2,可向工业Br2中 (填字母)。
a.通入HBr
b.加入NaBr溶液
c.加入Na2CO3溶液
d.加入Na2SO3溶液
正确答案
见解析。
解析
(1)
(2)Cl2+2Br—
(3)富集溴
(4)3Br2+3Na2CO3
(5)5
(6)b
知识点
海水是巨大的化学资源宝库。
Ⅰ.从海水中可以提取氯、溴、碘等卤族元素。
(1)Cl2的电子式是 。
(2)已知:X2 (g)+H2(g)
右图表示平衡常数K与温度t的关系。
①ΔH 表示X2与H2反应的焓变,ΔH 0。(填“>”、“<”或“=”)
② 曲线a表示的是 (填“Cl2”、“Br2”或“I2”)与H2反应时K与t的关系。
Ⅱ.海水淡化具有广泛的应用前景,淡化前需对海水进行预处理。
(1)通常用明矾[K2SO4·Al2(SO4)3·24H2O]作混凝剂,降低浊度。明矾水解的离子方程式是 。
(2)用下图所示NaClO的发生装置对海水进行消毒和灭藻处理。
① 装置中由NaCl转化为NaClO的化学方程式是 。
② 海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3。生成CaCO3的离子方程式是 。
③ 若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。
试用电极反应式并结合必要的文字进行解释 。
正确答案
见解析。
解析
Ⅰ.(1) 
(2)① <(2分);
② Cl2(2分)。
Ⅱ.(1)Al3++3H2O
(2)① 
2NaOH+Cl2=NaClO+NaCl+H2O ;
② Ca2++HCO3-+OH-=CaCO3↓+H2O ;
③ 阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的。
知识点
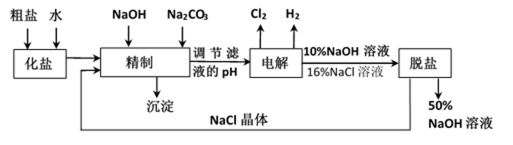
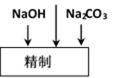
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图完成下列问题:
(1)在电解过程中,阴极上生成气体的电子式为 。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 。
(3)精制过程要除去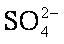
a. Ba(OH)2
b.Ba(NO3)2
c.BaCl2
(4)在实际生产中也可以用BaCO3除去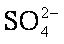
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、 (填操作名称)而制得50%的NaOH溶液。
正确答案
见解析。
解析
(1)H:H
(2)Mg2++2OH-=Mg(OH)2↓
(3)ac
(4)由于BaSO4比BaCO3的溶解度小,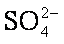

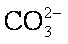
平衡正向移动,生成更难溶的BaSO4沉淀。
(5)结晶、过滤
知识点
水是最宝贵的资源之一。下列表述正确的是
正确答案
解析
略
知识点
水是最宝贵的资源之一。下列表述正确的是
正确答案
解析
略
知识点
硒(34Se)和碲(52Te)都是第VIA族元素,硒是分布在地壳中的稀有元素。工业上硒鼓废料(主要成分硒、碲、碳、铜和铁合金)回收精炼硒的流程如下:
已知:
(1)Se的氢化物的电子式是______。
(2)步骤①中通入的氧气使硒鼓废料翻腾,目的是______。
(3)废气的主要成分是______;废渣II的主要成分是______。
(4)步骤④中主要反应的化学方程式是______;步骤⑥反应的化学方程式是______。
(5)根据表中数据,步骤⑤最适宜的分离方法是______。
正确答案
见解析。
解析
(1)
(2)增大接触面积,加快反应速率,使废料充分燃烧
(3)CO2 TeO2
(4)
(5)升华,将温度控制在315℃到450℃之间
知识点
27.氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图完成下列问题:
(1)在电解过程中,阴极上生成气体的电子式为 。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 。
(3)精制过程要除去SO42-,可选择下列溶液中的 (填字母序号)
a. Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: 。
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、 (填操作名称)而制得50%的NaOH溶液。
(6)写出电解饱和食盐水的离子方程式:
正确答案
(1)H:H
(2)Mg2++2OH-=Mg(OH)2↓
(3)ac
(4)由于BaSO4比BaCO3的溶解度小,促使BaCO3(s)Ba2+(aq)+ (aq)
平衡正向移动,生成更难溶的BaSO4沉淀。
(5)结晶、过滤
(6)
解析
解析已在路上飞奔,马上就到!
知识点
26.A.B.C.D.E.F.G为原子序数依次递增的7种短周期主族元素。A.B元素的最高正价与最低负价的代数和均为零;C元素是植物生长三大营养元素之一;D的单质具有强氧化性,其氢化物能和一种半导体材料反应生成常温常压下的两种气体;E原子核外K层电子数与M层电子数相等;F原子的价电子数等于电子层数的两倍。请回答下列问题:
(1)CD3 的电子式为( );
(2)用离子方程式表示G 的非金属性比F强( );
(3)EF在空气中充分灼烧生成一种稳定性的盐,则此反应方程式为 ( );
(4)C的氢化物与G的单质以物质的量之比1:3反应,生成二元化合物X和一种气体,该气体遇氨气产生“白烟”,则X的化学是为( ),X与水反应的产物名称是( );
(5)已知充分燃烧一定量的B2A2放出Q kJ的能量,燃烧生成的产物恰好与100ml 5 
(6)常温下,E(OH)2在水中的沉淀溶解平衡曲线如图所示(单位

正确答案

解析
解析已在路上飞奔,马上就到!
知识点
27. 现有A、B、C、D、E五种原子序数依次增大的短周期元素,其中在所有的短周期元素中,A的原子半径与D的原子半径之比最小(不包括稀有气体),C与A、B、D均能形成多种常见化合物,B元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐,化合物AE常温下为气体。回答下列问题:
I.(1)A分别与B、C形成的最简单化合物中,稳定性( ) > ( )(用分子式表示),其中A与C形成的最简单化合物分子的空气构型为( )。
(2)化合物甲、乙均是由上述五种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1:1:1,其中乙是某种家用消毒液的有效成分,则化合物甲的电子式为( )。
(3)化合物丙由A和B两种元素组成,则化合物丙易液化的原因是( )。
(4)写出由这些元素组成一个不同主族单质间的置换反应方程式 ( )。
II.(1)金刚石属于( )晶体,如果其晶体中有1mol碳原子,则C—C键的数目为
NA。
(2)在氯化艳晶体中,与一个氯离子距离最近且相等的铯离子数是( )个。
(3)X射线测得氯化钠晶体中靠得最近的Na+与Cl—离子间的距离为dcm,经测定NaCl晶体的密度为

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28. A、B、C、D、E是由短周期元素组成的六种常见物质。已知:
①常温下均呈气态,其中B、C、F为单质;
②实验室制取B时,用排饱和食盐水法收集可减少B的水中的溶解;
③A与B反应生成C和D,A的水溶液呈碱性,D的水溶液呈酸性;
④C与F在放电条件下反应生成E,E遇空气变色。
回答下列问题:
(1)A的电子式是( ),实验室制取B的化学方程式为( ) 。
(2)A的水溶液呈碱性的原因是( )(结合化学用语说明),将等物质的量浓度、等体积的A、D溶液混合,所得溶液中离子浓度由大到小依次排列为( ) 。
(3)一定条件下A与F反应可生成C和一种无色无味液体,该反应中氧化剂与还原剂的物质的量之比为( )。
(4)组成C、B两物质的元素,按原子个数1:3形成化合物G,G是一种淡黄色液体,遇水即发生水解可生成一种具有漂白性的物质,写出反应的方程式 ( );该反应说明组成C、B两物质的元素中非金属性较强的是 ( )。(填元素符号)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析