- 元素电离能、电负性的含义及应用
- 共12题
(1)中国古代四大发明之一——黑火药,它的爆炸反应为
2KNO3+3C+S
①除S外,上列元素的电负性从大到小依次为 。
②在生成物中,A的晶体类型为 ,含极性共价键的分子的中心原子轨道杂化类型为 。
③已知



(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为 ,
(3


[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]x++xH+
交换出来的
将含0.0015 mol 

正确答案
(1)①

(2)
(3)
解析
(1)①钾为活泼金属,电负性比较小;C、N、O在同周期,非金属性逐渐增强,电负性也逐渐增大;②











(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,应该都属于元素Ⅷ,原子序数T比Q多2,可以确定T为




(3)中和生成的




知识点
(1)依据第2周期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:
2NH3+3F2 
①上述化学方程式中的5种物质所属的晶体类型有 (填序号)。
a。离子晶体 b。分子晶体 c,原子晶体 d。金属晶体
②基态铜原子的核外电子排布式为 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
①晶体Q中各种微粒间的作用力不涉及 (填序号)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.范德华力
②R中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化。
(4)已知苯酚(

正确答案
见解析。
解析
(1)
(2)①a、b、d ②1s22s22p63s23p63d104s1或[Ar]3d104s1
(3)①a、d ②三角锥型 sp3
(4)< 
知识点
碳族元素包括C 、Si、Ge .Sn、Pb
(1)碳纳米管由单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过___________杂化与周围碳原子成键,多层碳纳米管的层与层之间靠___________结合在一起。
(2)CH4共用电子对偏向C,SiH4中偏向H,则C、Si、H的电负性由大到小的顺序为___________。
(3)用阶层电子对互斥理论推断SnBr2分子中Sn—Br键的键角__________120○ (填“>、<、=”)
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞定点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心。该化合物化学式为____________,每个Ba2+与________个O2-配位。
正确答案
(1)sp2 范德华力
(2)C>H >Si
(3) <
(4)PbBaO3,12。
解析
(1)石墨的每个碳原子用sp2杂化轨道与邻近的三个碳原子以共价键结合,形成无限的六边形平面网状结构,每个碳原子还有一个与碳环平面垂直的未参与杂化的2p轨道,并含有一个未成对电子,这些平面网状结构再以范德华力结合形成层状结构。因碳纳米管结构与石墨类似,可得答案。
(2)共用电子对偏向电负性大的原子,故电负性:C>H >Si。
(3) SnBr2分子中,Sn原子的价层电子对数目是(4+2)/2=3,配位原子数为2,故Sn原子含有故对电子,SnBr2空间构型为V型,键角小于120°。
(4)每个晶胞含有Pb4+:8×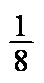
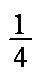
PbBaO3。Ba2+处于晶胞中心,只有1个,O2-处于晶胞棱边中心,共12个,
故每个Ba2+与12个O2-配位
知识点
氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是_________。
a. N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量
b. P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na
c. 基态As原子中,电子占据的最高能级为4d
d. Bi原子中最外层有5个能量相同的电子
(2)NH3在水中的溶解度比PH3大得多,其原因是_________。向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。该晶体中含有的化学键除普通的共价键外,还有_________和_________。
(3)PC13分子中,Cl—P—Cl键的键角_________109°28′(填“>”“<”或“=”)。
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。己知该晶体的密度为pg·cm-3,晶胞的边长为acm,则阿伏加德罗常数为_________mol-1(用含p、a的式子表示)。
正确答案
(1)b
(2)NH3分子与水分子之间能够形成氢键;离子键;配位键
(3)<
(4)496/(ρa3)
解析
略。
知识点
请回答下列问题:
(1)基态铬(Cr)原子的价电子排布式是________ ,这样排布使整个体系能量最低,原因是________。
(2)氨水中存在多种形式的氢键,其中与“氨极易溶于水”这种性质相关的氢键可表示为:________。解释NH3分子中键角大于H2O中的键角的原因是________。
(3)下列各项的比较中正确的是________。
A.第一电离能:Mg>Al
B.电负性:P>Ge
C.稳定性:AsH3>H2S
D.金属性:20X<30Y
(4)Fe单质的晶体在不同温度下有两种堆积方式,晶胞结构如图所示,面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
正确答案
(1)3d54s1;3d、4s轨道上的电子均为半充满状态
(2) O-H…N N…H-O;NH3分子 中N原子采用sp3杂化后,N原子还有一对孤对电子,而H2O分子 中O原子采用sp3杂化后,O原子有两对孤对电子,对成键电子的排斥作用更强,使键角更小。
(3) AB
(4)1:2
解析
略。
知识点
A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,D的原子半径是同周期原子中最小的。
根据以上信息,回答下列问题:
(1)上述A、B、C、D四种元素中第一电离能最小的是_________,电负性最大的是_________,原子半径由小到大的顺序为_________。(填相关元素的元素符号)
(2)A和D的氢化物中,沸点较高的是_________(填相关物质的分子式):其原因是_________。
(3)A和E可形成离子化合物,其晶胞结构如图所示,则每个晶胞中含阳离子的数目为_________,含阴离子的数目为_________,该离子化合物的化学式为_________。
正确答案
(1)Na;F;F < Cl < Al < Na
(2)HF,因为HF分子间存在氢键
(3)4;8;CaF2
解析
略。
知识点
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子轨道示意图为 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键,又含有非极性共价键的化合物是 (填化学式,写两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是 ;酸根呈三角锥结构的酸是 。(填化学式)
(4)c和e形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈轴向狭长的八面体结构(如图2所示)。该化合物中阴离子为 ,阳离子中存在的化学键类型有 ;该化合物加热时首先失去的组分是 ,判断理由是 。
正确答案
(1)N
(2) 

(3)

(4) +1
(5)




解析
略
知识点
下列说法正确的是
正确答案
解析
略。
知识点
化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得。A在一定条件下通过多步去氢可最终转化为氮化硼(BN)。请回答:
(1)与(HB=NH)3互为等电子体的分子为 (填分子式)。
(2)下列关于合成A的化学方程式的叙述不正确的是 (填选项字母)。
a.反应前后碳原子的轨道杂化类型不变
b.CH4、H2O、CO2的分子空间构型分别为正四面体形、V形、直线形
c.第一电离能的大小关系为:N>O>C>B
d.A中存在配位键
(3)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中共有
个硼原子, 个氮原子。
(4)人工可以合成硼的一系列氮化物,其物理性质与烷烃相似,故称之为硼烷。工业上采用LiAlH4和BF3,在乙醚介质中反应制得乙硼烷(B2H6) ,同时生成另外两种产物,该反应的化学方程式为 。
(5)相关化学键的键能如下表所示,简要分析和解释下列事实。
自然界中不存在硼单质,硼氢化物也很少,主要是含氧化物,其原因为
(6)在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式,图(a)为一种无限长单链状结构的多碰酸根,其化学式为 ;图(b)为硼砂晶体中的阴离子,其中硼原子采取的杂化类型 。
正确答案
(1)C6H6
(2)a
(3)4 ; 4
(4)3LiAlH4+4BF3
(5)B—O键键能大于B—B键和B—H键,所以更易形成稳定性更强的B—O键
(6)[BO2]nn-或BO2- ; sp2、sp3
解析
略
知识点
决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)N、O、S三种元素的第一电离能从大到小的顺序为________。
(2)甲醛(H2C=O)分子碳原子的杂化方式为________用价层电子对互斥理论推断甲醛中H—C—H的键角________120o(填 “>”“<”或“=”)。
(3)科学家通过X射线探明,KCl、MgO、CaO的晶体结构与NaCl的晶体结构相似(图a所示)。KCl、CaO、MgO三种离子晶体熔点从高到低的顺序是________。
设MgO晶胞的边长为acm,则MgO的密度是________g·cm-3(只要求列算式。阿伏伽德罗常数为NA)。
(5)某配合物的分子结构如图b所示,其分子内不含有________(填字母)。
A.离子键
B.共价键
C.金属键
D.配位键
E.氢键
F.Π键
正确答案
(1)N>O>S
(2)sp2;<
(3)MgO>CaO>KCl
(4)160/a3 NA
(5)AC
解析
(1)根据同周期同主族元素性质递变规律判断,同一周期由左向右元素原子的第一电离能呈递增趋势,但氮原子2p轨道为半充满状态,第一电离能比相邻的元素都大;同主族由上到下元素原子的第一电离能逐渐减小,N、O、S三种元素的第一电离能从大到小的顺序为N>O>S。
(2)甲醛(H 2 C=O)分子碳原子的杂化方式为sp2;甲醛(H 2 C=O)分子中氧原子上含有两对孤对电子,对成键电子对有排斥作用,甲醛中H—C—H的键角<120o 。
(3)对于结构相似的离子晶体,晶格能越大晶体的熔点越高;晶格能的高低取决于离子半径和离子所带的电荷,离子半径越小,所带电荷越多,晶格能越大,熔点越高;则KCl、CaO、MgO三种离子晶体熔点从高到低的顺序是MgO>CaO>KCl。
(4)根据MgO晶胞结构利用切割法分析知,1mol晶胞中含有4molMgO,质量为160g,晶胞的边长为acm,则1mol晶胞的体积为a3NAcm3则MgO的密度是160/a3NAg·cm-3 。
(5)根据配合物的分子结构判断,其分子内不含有离子键和金属键,选AC。
知识点
扫码查看完整答案与解析
















