- 化学平衡的计算
- 共48题
氨是重要的化工产品和化工原料。
(1)氨的电子式是 。
(2)已知:
① 合成氨的热化学方程式是 。
② 降低温度,该反应的化学平衡常数K (填“增大”、“减小”或“不变”)。
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图1所示。
电池正极的电极反应式是 ,A是 。
(4)用氨合成尿素的反应为2NH3(g)+CO2(g)
① 曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是______。
② 测得B点氨的转化率为40%,则x1=______。
正确答案
见解析。
解析
(1)
(2)① N2(g)+3H2(g)=2NH3(g) ΔH= - 92 kJ/mol
② 增大
(3)N2+8H++6e-=2NH4+;NH4Cl
(4)III;3
知识点
在100℃时,将N2O4、NO2分别充入两个各为1 L的密闭容器中,反应过程中浓度变化如下:[2NO2(g) 
下列说法正确的是
正确答案
解析
略
知识点
已知: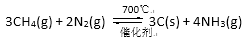
下列说法正确的是
正确答案
解析
略
知识点
11. 温度为T时,向2.0L恒容密闭容器中充入1.00 mol PCl5,反应PCl5(g)→PCl3(g)+Cl2(g)+Q经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
下列说法正确的是( )
正确答案
解析
略
知识点
已知A(g)+B(g) 
830℃时,向一个2 L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4 s内A的平均反应速率v(A)=0.005 mol/(L·s)。下列说法正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析








