- 常见有机化合物的结构
- 共41题
联苄(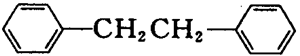
(一)催化剂的制备
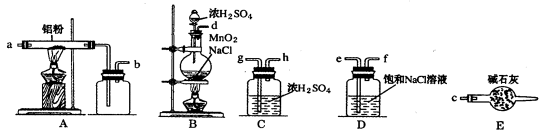
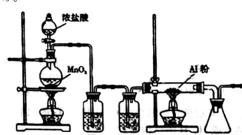
下图是实验室制取少量无水AlCl3的相关实验装置的仪器和药品:
(二)联苄的制备
联苄的制取原理为:
反应最佳条件为n(苯) :n(1,2-二氯乙烷)=10 :1,反应温度在60-65℃之间。
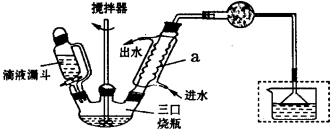
实验室制取联苄的装置如下图所示(加热和加持仪器略去):
实验步骤:
在三口烧瓶中加入120.0
氯乙烷,控制反应温度在60-65℃,反应约60min。将反应后的混合物依次用稀盐酸、
2%Na2CO3溶液和H2O洗涤分离,在所得产物中加入少量无水MgSO4固体,静止、过
滤,先常压蒸馏,再减压蒸馏收集170~172℃的馏分,得联苄18.2 g。
相关物理常数和物理性质如下表
8.将上述仪器连接成一套制备并保存无水AlCl3的装置,各管口标号连接顺
9.有人建议将上述装
10.装置A中隐藏着一种安全隐患,请提出一种改进方案:_____________。
11.仪器a的名称为______________,和普通分液漏斗相比,使用滴液漏斗的优点是_
12.洗涤操作中,水洗的目的是_____________;无水硫酸镁的作用是______________。
13.常压蒸馏时,最低控制温度是________________。
14.该实验的产率约为______________。(小数点后保留两位有效数字)
正确答案
f,g,h,a,b,c
解析
【解析】将上述仪器连接成一套制备并保存无水AlCl3的装置,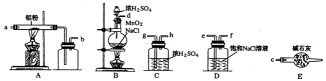

考查方向
解题思路
A装置用于Al和氯气反应,B用于产生氯气,C用于干燥气体,D用于除去HCl。E用于干燥,防止AlCl3遇水反应。Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸。无水氯化铝遇到湿空气产生大量白雾。球形冷凝管和普通分液漏斗相比的优点是可以使液体顺利滴下。
易错点
无水氯化铝遇到湿空气产生大量白雾、制备实验方案的设计。
正确答案
可行,制得的Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸。
解析
有人建议将上述装
考查方向
解题思路
A装置用于Al和氯气反应,B用于产生氯气,C用于干燥气体,D用于除去HCl。E用于干燥,防止AlCl3遇水反应。Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸。无水氯化铝遇到湿空气产生大量白雾。球形冷凝管和普通分液漏斗相比的优点是可以使液体顺利滴下。
易错点
无水氯化铝遇到湿空气产生大量白雾、制备实验方案的设计。
正确答案
玻璃管与广口瓶之间用粗导管连接,防止AlCl3冷凝成固体造成堵塞。
解析
【解析】装置A中隐藏着一种安全隐患,无水氯化铝遇到湿空气产生大量白雾,白雾的成分是含结晶水的氯化铝固体,大量白雾会造成瞬间管道堵塞(正常情况下,管道是不堵塞的,因为是氯气携带气态无水氯化铝缓慢流过).因此,改用直接引入氯气的方法,例如灌装液氯.或在硬质玻璃管与广口瓶之间用粗导管连接,防止AlCl3冷凝成固体造成堵塞。
考查方向
解题思路
A装置用于Al和氯气反应,B用于产生氯气,C用于干燥气体,D用于除去HCl。E用于干燥,防止AlCl3遇水反应。Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸。无水氯化铝遇到湿空气产生大量白雾。球形冷凝管和普通分液漏斗相比的优点是可以使液体顺利滴下。
易错点
无水氯化铝遇到湿空气产生大量白雾、制备实验方案的设计。
正确答案
球形冷凝管;可以使液体顺利滴下。
解析
仪器a的名称为球形冷凝管,和普通分液漏斗相比,使用滴液漏斗的优点是可以使液体顺利滴下。
考查方向
解题思路
A装置用于Al和氯气反应,B用于产生氯气,C用于干燥气体,D用于除去HCl。E用于干燥,防止AlCl3遇水反应。Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸。无水氯化铝遇到湿空气产生大量白雾。球形冷凝管和普通分液漏斗相比的优点是可以使液体顺利滴下。
易错点
无水氯化铝遇到湿空气产生大量白雾、制备实验方案的设计。
正确答案
球形冷凝管;可以使液体顺利滴下。
解析
洗涤操作中,水洗的目的是洗掉Na2CO3(或洗掉可溶性无机物);无水硫酸镁的作用是吸水剂(干燥剂)。
考查方向
解题思路
A装置用于Al和氯气反应,B用于产生氯气,C用于干燥气体,D用于除去HCl。E用于干燥,防止AlCl3遇水反应。Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸。无水氯化铝遇到湿空气产生大量白雾。球形冷凝管和普通分液漏斗相比的优点是可以使液体顺利滴下。
易错点
无水氯化铝遇到湿空气产生大量白雾、制备实验方案的设计。
正确答案
83.5℃
解析
常压蒸馏时,最低控制温度是83.5℃。
考查方向
解题思路
A装置用于Al和氯气反应,B用于产生氯气,C用于干燥气体,D用于除去HCl。E用于干燥,防止AlCl3遇水反应。Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸。无水氯化铝遇到湿空气产生大量白雾。球形冷凝管和普通分液漏斗相比的优点是可以使液体顺利滴下。
易错点
无水氯化铝遇到湿空气产生大量白雾、制备实验方案的设计。
正确答案
72.85%
解析
该实验的产率约为72.85%。(小数点后保留两位有效数字)
考查方向
解题思路
A装置用于Al和氯气反应,B用于产生氯气,C用于干燥气体,D用于除去HCl。E用于干燥,防止AlCl3遇水反应。Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸。无水氯化铝遇到湿空气产生大量白雾。球形冷凝管和普通分液漏斗相比的优点是可以使液体顺利滴下。
易错点
无水氯化铝遇到湿空气产生大量白雾、制备实验方案的设计。
2.下列描述正确的是()
正确答案
解析
A、16O→18O的转化,中子数的改变不属于化学变化,化学变化在原子重组层面上;
B、冰醋酸在水溶液中电离出的阳离子全部是氢离子,属于酸;消石灰在水溶液中电离出的阴离子全部是氢氧根离子,属于碱,明矾能电离出金属阳离子铝离子、钾离子和酸根阴离子硫酸根离子,属于盐,生石灰含有两种元素,其中一种是氧元素,属于氧化物,故B正确;
C、SiO2既能与氢氟酸反应生成四氟化硅和水,不是生成盐和水,能与氢氧化钠溶液反应生成盐和水,只是属于酸性氧化物,故C错误;
D、少量Cu将足量浓、稀硝酸分别还原为NO2和NO,电子转移的量金属铜的物质的量,其转移电子数之比为1:1,故D错误.
考查方向
解题思路
A、16O→18O的转化,中子数的改变不属于化学变化,化学变化在原子重组层面上;
B、酸、碱、盐、氧化物的组成结构概念;
C、两性氧化物是指既能和酸反应生成盐和水又能和碱反应生成盐和水的氧化物;
D、少量Cu将足量浓、稀硝酸分别还原为NO2和NO,电子转移的物质的量取决于金属铜的物质的量.
易错点
中子数的改变不属于化学变化,化学变化在原子重组层面上。
知识点
3.2015年10月5日,中国著名药学家屠呦呦获得诺贝尔奖生理学或医学奖,获奖理由是“因为发现青蒿素—一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命”。青蒿素是从植物黄花蒿茎叶中提取的,其结构简式如右图,下列说法不正确的是( )
正确答案
解析
A.根据有机物的结构简式可知,分子中有7个手性碳原子,分别如图,A错误。
B..根据青蒿素的结构简式可知,它的一个分子中含有的C、H、O三种原子的个数分别是15、22、5个,所以分子式为C15H2205;,B正确;
C.根据青蒿素的结构简式可知青蒿素的分子中含有过氧键,所以是有机过氧化物,有强氧化性,它不稳定,易受湿、热和还原性物质的影响而变质,C正确;
D.青蒿素是有机物,易溶于非极性的有机溶剂,但是青蒿素分子中不含有易溶于水的官能团(即亲水基团),所以在水中的溶解性不大,D正确。
考查方向
解题思路
A.手性碳原子存在于许多有机化合物中,连有四个不同基团的碳原子就是手性碳原子;B.根据青蒿素的结构简式可知,它的一个分子中含有的C、H、O三种原子的个数分别是15、22、5个,所以分子式为C15H2205;C.含有过氧基团的有机化合物称为有机过氧化物。有机过氧化物的氧化性比较强,都是易燃、易爆的化合物,可用作杀菌剂、清毒剂、漂白剂;D.大多数有机物易溶于非极性的有机溶剂(如苯、汽油、四氯化碳、酒精等),但是只有含有易溶于水的官能团(即亲水基团)有—OH、—CHO、—COOH、—NH2时,且亲水基团的个数越多,物质的溶解性越大;
易错点
A.不能正确判断手性碳原子的结构特点;B.没有掌握有机化合物分子式的确定方法;C.没有掌握过氧基团的性质特点;D.对有机化合物的溶解度规律不熟悉。
知识点
8.一氧化碳是一种用途广泛的化工基础原料。有机物加氢反应中镍是常用的催化剂。但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资料如下:
则:(1)① 不用通入O2氧化的方法除去CO的原因是___________________________。
② SO2(g) + 2CO(g) = S(s) + 2CO2(g) △H =_________________________。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) 
(3)为减少雾霾、降低大气中有害气体含量, 研究机动车尾气中CO、NOx及CxHy的排放量意义重大。机动车尾气污染物的含量与空/燃比 (空气与燃油气的体积比)的变化关系示意图如图所示,请解释:
①随空/燃比增大,CO和CxHy的含量减少的原因是__________________。
②当空/燃比达到15后,NOx减少的原因可能是_____________。
正确答案
(1)① Ni会与氧气反应
② -270.0KJ/mol
(2)75% , 0.045 mol·L-1·min-1
(3)①空/燃比增大,燃油气燃烧更充分,故CO、CxHy含量减少
②因为反应 N2(g)+O2(g)
解析
(1)①Ni能与氧气反应也会导致其中毒,故答案为:Ni会与氧气反应;
②由图I可知,O2(g)+2CO(g)=2CO2(g)△H=(-2×283)kJ•mol-1=-566kJ•mol-1,(i)
由图II可知,S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,(ii)
(i)-(ii)得:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-563-(-298)=-270kJ•mol-1,故答案为:-270kJ/mol;
(2)设参加反应的CO的浓度为x
CO(g)+H2O(g)

所以CO的转化率
氢气反应速率
故答案为:75%;0.045mol/(L•min);
(3)①空/燃比增大,燃油气燃烧更充分,故答案为:空/燃比增大,燃油气燃烧更充分,故CO、CxHy含量减少;
②反应 N2(g)+O2(g)
考查方向
解题思路
(1)①Ni能与氧气反应也会导致其中毒,据此解答即可;
②利用盖斯定律进行计算即可;
(2)根据所给反应的平衡常数,利用三段式法计算出平衡浓度减小求算,
CO(g)+H2O(g)
(3)①燃油气燃烧更充分;
②反应 N2(g)+O2(g)
易错点
(5)中据机动车尾气污染物的含量与空/燃比的变化关系示意图的原因分析
知识点
醋酸镍[(CH3COO)2Ni]是一种重要醋酸镍的工艺流程图如下:
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:
15.调节pH步骤中,溶液pH的调节范围是____________。
16.滤渣1和滤渣3主要成分的化学式分别是____________、_____________。
17.写出氧化步骤中加入H2O2发生反应的离子方程式_____________。
18.酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式_______________。
19.沉镍过程中,若c(Ni2+)=2.0 mol· L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为__________g。(保留小数点后1位有效数字)
20.保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为________℃、_______min。
正确答案
5.0≤pH<6.7
解析
调节pH步骤中,溶液pH的调节范围是5.0≤pH<6.7。
考查方向
解题思路
制取醋酸镍的工艺流程图:
含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎后加酸浸的过程可将金属化合物离子化,从而得到Ni2+、Al3+、Fe2+、Ca2+,加过氧化氢将S2-和Fe2+氧化,利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)并加乙酸制取醋酸镍。
易错点
分析表格利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)。
正确答案
SiO2、 CaSO4 CaF2
解析
滤渣1和滤渣3主要成分的化学式分别是SiO2、 CaSO4 CaF2 。
考查方向
解题思路
制取醋酸镍的工艺流程图:
含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎后加酸浸的过程可将金属化合物离子化,从而得到Ni2+、Al3+、Fe2+、Ca2+,加过氧化氢将S2-和Fe2+氧化,利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)并加乙酸制取醋酸镍。
易错点
分析表格利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)。
正确答案
2Fe2+ + H2O2 +2H+ == 2Fe3+ + 2H2O
解析
写出氧化步骤中加入H2O2发生反应的离子方程式2Fe2+ + H2O2 +2H+ == 2Fe3+ + 2H2O 。
考查方向
解题思路
制取醋酸镍的工艺流程图:
含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎后加酸浸的过程可将金属化合物离子化,从而得到Ni2+、Al3+、Fe2+、Ca2+,加过氧化氢将S2-和Fe2+氧化,利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)并加乙酸制取醋酸镍。
易错点
分析表格利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)。
正确答案
NiS + H2SO4 + 2HNO3 ==
解析
酸浸过程中,lmol NiS失去6NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式NiS + H2SO4 + 2HNO3 ==
考查方向
解题思路
制取醋酸镍的工艺流程图:
含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎后加酸浸的过程可将金属化合物离子化,从而得到Ni2+、Al3+、Fe2+、Ca2+,加过氧化氢将S2-和Fe2+氧化,利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)并加乙酸制取醋酸镍。
易错点
分析表格利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)。
正确答案
31.4g
解析
沉镍过程中,若c(Ni2+)=2.0 mol· L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为31.4g g。
考查方向
解题思路
制取醋酸镍的工艺流程图:
含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎后加酸浸的过程可将金属化合物离子化,从而得到Ni2+、Al3+、Fe2+、Ca2+,加过氧化氢将S2-和Fe2+氧化,利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)并加乙酸制取醋酸镍。
易错点
分析表格利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)。
正确答案
70 120
解析
保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如右图。酸浸的最佳温度与时间分别为70℃、120min。
考查方向
解题思路
制取醋酸镍的工艺流程图:
含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)粉碎后加酸浸的过程可将金属化合物离子化,从而得到Ni2+、Al3+、Fe2+、Ca2+,加过氧化氢将S2-和Fe2+氧化,利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)并加乙酸制取醋酸镍。
易错点
分析表格利用相关离子生成氢氧化物的pH和相关物质的溶解性(NiF可溶,CaF微溶,碳酸镍难溶)的不同,除去Al3+、Fe2+、Ca2+最后加纯碱沉淀镍(碳酸镍难溶)。
7.某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO、MnO、CO、SO中的若干种组成,取该溶液进行如下实验:
① 取适量试液,加入过量盐酸,有气体生成,并得到澄清溶液;
② 在①所得溶液中再加入过量碳酸氢铵溶液,有气体生成;同时析出白色沉淀甲;
③ 在②所得溶液中加入过量B
根据对上述实验的分析判断,最后得出的结论合理的是( )
正确答案
解析
某无色溶液,说明溶液中一定不会存在MnO,
①加入过量盐酸,有气体生成,并得到无色溶液,生成的气体为二氧化碳,所以溶液中一定存在CO32-,一定不存在Ag+、Ba2+、Al3+,阳离子只剩下了钠离子,根据溶液一定呈电中性可知溶液中一定存在Na+;
②在①所得溶液中加入过量NH4HCO3溶液,有气体生成,同时析出白色沉淀甲,白色沉淀甲为氢氧化铝,原溶液中一定存在AlO2-,
③在②所得溶液中加入过量Ba(OH)2溶液,也有气体生成,同时析出白色沉淀乙,白色沉淀一定含有碳酸钡,可能含有硫酸钡;所以溶液中一定存在的离子有:CO32-、Na+、AlO2-,银离子一定不存在;故选A.
考查方向
解题思路
溶液无色,一定没有MnO,
①能够与盐酸生成气体的离子为CO,能够与CO反应的离子不能存在;
②说明发生了双水解,一定存在与碳酸氢根离子发生双水解的离子;
③气体为氨气,白色沉淀为碳酸钡或硫酸钡,据此进行推断.
易错点
容易忽视根据电荷守恒判断一定存在Na+。
知识点
选做题:请从32、33两题中任选一题
32.【化学——物质的结构】
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物。氢化物晶体的结构有共价型和离子型之分。
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO简写为Ac)。反应方程式为:[Cu(NH3)2]Ac+ CO+NH3
①请写出基态Cu原子的电子排布式__________。
②氨水溶液中各元素原子的电负性从大到小排列顺序为__________。
③醋酸分子中的两个碳原子,甲基(—CH3)碳和羧基(—COOH)碳的杂化方式分别是__________。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有__________。
a.离子键 b. 配位键
c. σ键 d. π键
(2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞__________。(填“侧面”或“内部”)
②XY2晶体、硅烷晶体和固态氨3种氢化物熔沸点高低顺序正确的是__________。
a.XY2晶体>硅烷晶体>固态氨
b.XY2晶体>固态氨>硅烷晶体
c.固态氨>硅烷晶体>XY2晶体
d.硅烷晶体>固态氨>XY2晶体
33.【化学——有机化学】
合成某药物的流程“片段”如下:
已知:
请回答下列问题:
(1)A的名称是__________。
(2)反应②的化学方程式__________。
(3)B的结构简式为__________。
(4)X是
(5)某同学补充A到B的流程如下:
①A→T,如果条件控制不好,可能生成副产物,写出一种副产物的结构简式__________。
②若步骤II和III互换,后果可能是__________.
正确答案
33.【化学——物质的结构】
(1)
① [Ar]3d104s1
②O > N >H
③sp3;sp2
④abcd
(2)
① 内部;
②b
34.【化学——有机化学】
(1)甲苯
(2)
(3)
(4)3
(5)
①
②氨基被氧化(产品含杂质多,产率低)
解析
解析已在路上飞奔,马上就到!
知识点
20.在常温下,0.1000mol·L-1Na2CO3溶液25mL 用0.1000mol·L-1盐酸滴定,其滴定曲线如图。对滴定过程中所得溶液中相关离子浓度间的关系,下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
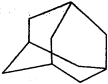
9.下图是金刚烷的结构示意图,1-溴金刚烷可用于合成甲型流感病毒的抑制剂。下列有关说法中正确的是
正确答案
解析
A.从金刚烷的结构简式可以看出金刚烷的分子式为C10H16,金刚烷分子中有10个碳原子,A错误;
B.从金刚烷的结构简式可以看出金刚烷分子含有2种等效氢原子,因此1-溴金刚烷的结构有两种,B正确;
C.烷烃的同系物的通式为:CnH2n+2,金刚烷不属于烷烃的同系物,C错误;
D.金刚烷所有的碳原子都是饱和的,不具有芳香烃相似的化学性质,D错误。
故选B。
考查方向
解题思路
A.从金刚烷的结构简式可以看出金刚烷的分子式为C10H16,金刚烷分子中有10个碳原子;
B.从金刚烷的结构简式可以看出金刚烷分子含有2种等效氢原子,因此1-溴金刚烷的结构有两种;
C.烷烃的同系物的通式为:CnH2n+2,金刚烷不属于烷烃的同系物;
D.金刚烷所有的碳原子都是饱和的,不具有芳香烃相似的化学性质。
易错点
解题注意金刚烷的结构简式可以看出金刚烷分子含有2种等效氢原子。
知识点
下列有关化学用语中正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析