- 物质结构与性质
- 共518题
过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室可用工业碳酸钙(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙,其主要流程如下:
已知:CaO2·8H2O呈白色微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全。
22.写出反应①中氧化还原反应的离子方程式:___________________________。
23.向反应①后的溶液中加浓氨水的目的是:_________________________________,
______________________________(用方程式表示)
24.反应②常用冰水控制温度在0℃左右,其可能原因是(写出两种):
①__________________________;②__________________________。
25.测定产品中CaO2的含量的实验步骤是
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。已知:I2+2S2O===2I-+S4O。
某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能________(填“不受影响”“偏低”或“偏高”),原因是____________________.
正确答案
3FeCO3+10H++NO3-===3Fe3++NO↑+3CO2↑+5H2O
解析
反应①中氧化还原反应的离子方程式:3FeCO3+10H++NO3-===3Fe3++NO↑+3CO2↑+5H2O
考查方向
解题思路
工业碳酸钙(含MgCO3、FeCO3等杂质)加硝酸(强氧化性)反应成Mg2+、Fe3+
易错点
根据图示流程中找出反应物、生成物,写出反应的化学方程式。
正确答案
Mg2+、Fe3+沉淀完全(方程式略)
解析
由流程可知,反应物为Mg2+、Fe3+与氨气和水反应将生成氢氧化镁和氢氧化铁沉淀。
考查方向
解题思路
向反应①后的溶液中加浓氨水的目的由流程可知,反应物为Mg2+、Fe3+与氨气和水反应将生成氢氧化镁和氢氧化铁沉淀。
易错点
根据图示流程中找出反应物、生成物,写出反应的化学方程式。
正确答案
①防止H2O2分解,提高其利用率
②降低CaO2·8H2O溶解度,提高产率
解析
由于双氧水受热易分解,所以温度低可减少过氧化氢的分解,提高过氧化氢的利用率;另一方面该反应是放热反应,温度低有利于提高CaO2·8H2O产率。
考查方向
解题思路
温度低可减少过氧化氢的分解,有利于提高CaO2·8H2O产率。
易错点
根据图示流程中找出反应物、生成物,写出反应的化学方程式。
正确答案
偏高 在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高
解析
如果滴速过慢,而空气中的氧气在酸性条件下也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高。
考查方向
解题思路
空气中的氧气在酸性条件下也可以把KI氧化为I2。
易错点
根据空气中的氧气能够氧化碘离子,使碘单质的量增加,消耗的硫代硫酸钠增加分析。
14.图示是

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.丙烯酸的结构简式为CH2= CH-COOH,下列关于丙烯酸的说法错误的是( )
正确答案
解析
A、丙烯酸含有羧基,所以能与醇发生酯化反应;
B、丙烯酸含有碳碳双键,所以能使酸性高锰酸钾溶液发生氧化反应;
C、丙烯酸与HBr发生加成反应能得到2种产物H加在CH2= CH左侧和右侧;
D、丙烯酸钠溶液中丙烯酸根离子会发生水解;
考查方向
解题思路
丙烯酸中含有的官能团是碳碳双键和羧基,所以丙烯酸具有烯烃和羧酸的性质
易错点
本题考查有机物的结构和性质,易错点在于明确丙烯酸含有的官能团以及官能团所具有的性质是解本题的关键。
知识点
(1)中国古代四大发明之一——黑火药,它的爆炸反应为
2KNO3+3C+S
①除S外,上列元素的电负性从大到小依次为 。
②在生成物中,A的晶体类型为 ,含极性共价键的分子的中心原子轨道杂化类型为 。
③已知



(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为 ,
(3


[CrCln(H2O)6-n]x++xR-H→Rx[CrCln(H2O)6-n]x++xH+
交换出来的
将含0.0015 mol 

正确答案
(1)①

(2)
(3)
解析
(1)①钾为活泼金属,电负性比较小;C、N、O在同周期,非金属性逐渐增强,电负性也逐渐增大;②











(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,应该都属于元素Ⅷ,原子序数T比Q多2,可以确定T为




(3)中和生成的




知识点
(1)依据第2周期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:
2NH3+3F2 
①上述化学方程式中的5种物质所属的晶体类型有 (填序号)。
a。离子晶体 b。分子晶体 c,原子晶体 d。金属晶体
②基态铜原子的核外电子排布式为 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
①晶体Q中各种微粒间的作用力不涉及 (填序号)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.范德华力
②R中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化。
(4)已知苯酚(

正确答案
见解析。
解析
(1)
(2)①a、b、d ②1s22s22p63s23p63d104s1或[Ar]3d104s1
(3)①a、d ②三角锥型 sp3
(4)< 
知识点
碳族元素包括C 、Si、Ge .Sn、Pb
(1)碳纳米管由单层或多层石墨层卷曲而成,其结构类似于石墨晶体,每个碳原子通过___________杂化与周围碳原子成键,多层碳纳米管的层与层之间靠___________结合在一起。
(2)CH4共用电子对偏向C,SiH4中偏向H,则C、Si、H的电负性由大到小的顺序为___________。
(3)用阶层电子对互斥理论推断SnBr2分子中Sn—Br键的键角__________120○ (填“>、<、=”)
(4)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞定点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心。该化合物化学式为____________,每个Ba2+与________个O2-配位。
正确答案
(1)sp2 范德华力
(2)C>H >Si
(3) <
(4)PbBaO3,12。
解析
(1)石墨的每个碳原子用sp2杂化轨道与邻近的三个碳原子以共价键结合,形成无限的六边形平面网状结构,每个碳原子还有一个与碳环平面垂直的未参与杂化的2p轨道,并含有一个未成对电子,这些平面网状结构再以范德华力结合形成层状结构。因碳纳米管结构与石墨类似,可得答案。
(2)共用电子对偏向电负性大的原子,故电负性:C>H >Si。
(3) SnBr2分子中,Sn原子的价层电子对数目是(4+2)/2=3,配位原子数为2,故Sn原子含有故对电子,SnBr2空间构型为V型,键角小于120°。
(4)每个晶胞含有Pb4+:8×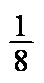
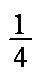
PbBaO3。Ba2+处于晶胞中心,只有1个,O2-处于晶胞棱边中心,共12个,
故每个Ba2+与12个O2-配位
知识点
氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是_________。
a. N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量
b. P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na
c. 基态As原子中,电子占据的最高能级为4d
d. Bi原子中最外层有5个能量相同的电子
(2)NH3在水中的溶解度比PH3大得多,其原因是_________。向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。该晶体中含有的化学键除普通的共价键外,还有_________和_________。
(3)PC13分子中,Cl—P—Cl键的键角_________109°28′(填“>”“<”或“=”)。
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。己知该晶体的密度为pg·cm-3,晶胞的边长为acm,则阿伏加德罗常数为_________mol-1(用含p、a的式子表示)。
正确答案
(1)b
(2)NH3分子与水分子之间能够形成氢键;离子键;配位键
(3)<
(4)496/(ρa3)
解析
略。
知识点
A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,D的原子半径是同周期原子中最小的。
根据以上信息,回答下列问题:
(1)上述A、B、C、D四种元素中第一电离能最小的是_________,电负性最大的是_________,原子半径由小到大的顺序为_________。(填相关元素的元素符号)
(2)A和D的氢化物中,沸点较高的是_________(填相关物质的分子式):其原因是_________。
(3)A和E可形成离子化合物,其晶胞结构如图所示,则每个晶胞中含阳离子的数目为_________,含阴离子的数目为_________,该离子化合物的化学式为_________。
正确答案
(1)Na;F;F < Cl < Al < Na
(2)HF,因为HF分子间存在氢键
(3)4;8;CaF2
解析
略。
知识点
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子轨道示意图为 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键,又含有非极性共价键的化合物是 (填化学式,写两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是 ;酸根呈三角锥结构的酸是 。(填化学式)
(4)c和e形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈轴向狭长的八面体结构(如图2所示)。该化合物中阴离子为 ,阳离子中存在的化学键类型有 ;该化合物加热时首先失去的组分是 ,判断理由是 。
正确答案
(1)N
(2) 

(3)

(4) +1
(5)




解析
略
知识点
下列说法正确的是
正确答案
解析
略。
知识点
请回答下列问题:
(1)基态铬(Cr)原子的价电子排布式是________ ,这样排布使整个体系能量最低,原因是________。
(2)氨水中存在多种形式的氢键,其中与“氨极易溶于水”这种性质相关的氢键可表示为:________。解释NH3分子中键角大于H2O中的键角的原因是________。
(3)下列各项的比较中正确的是________。
A.第一电离能:Mg>Al
B.电负性:P>Ge
C.稳定性:AsH3>H2S
D.金属性:20X<30Y
(4)Fe单质的晶体在不同温度下有两种堆积方式,晶胞结构如图所示,面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为________。
正确答案
(1)3d54s1;3d、4s轨道上的电子均为半充满状态
(2) O-H…N N…H-O;NH3分子 中N原子采用sp3杂化后,N原子还有一对孤对电子,而H2O分子 中O原子采用sp3杂化后,O原子有两对孤对电子,对成键电子的排斥作用更强,使键角更小。
(3) AB
(4)1:2
解析
略。
知识点
化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过反应3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3制得。A在一定条件下通过多步去氢可最终转化为氮化硼(BN)。请回答:
(1)与(HB=NH)3互为等电子体的分子为 (填分子式)。
(2)下列关于合成A的化学方程式的叙述不正确的是 (填选项字母)。
a.反应前后碳原子的轨道杂化类型不变
b.CH4、H2O、CO2的分子空间构型分别为正四面体形、V形、直线形
c.第一电离能的大小关系为:N>O>C>B
d.A中存在配位键
(3)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中共有
个硼原子, 个氮原子。
(4)人工可以合成硼的一系列氮化物,其物理性质与烷烃相似,故称之为硼烷。工业上采用LiAlH4和BF3,在乙醚介质中反应制得乙硼烷(B2H6) ,同时生成另外两种产物,该反应的化学方程式为 。
(5)相关化学键的键能如下表所示,简要分析和解释下列事实。
自然界中不存在硼单质,硼氢化物也很少,主要是含氧化物,其原因为
(6)在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式,图(a)为一种无限长单链状结构的多碰酸根,其化学式为 ;图(b)为硼砂晶体中的阴离子,其中硼原子采取的杂化类型 。
正确答案
(1)C6H6
(2)a
(3)4 ; 4
(4)3LiAlH4+4BF3
(5)B—O键键能大于B—B键和B—H键,所以更易形成稳定性更强的B—O键
(6)[BO2]nn-或BO2- ; sp2、sp3
解析
略
知识点
决定物质性质的重要因素是物质的结构。请回答下列问题:
(1)N、O、S三种元素的第一电离能从大到小的顺序为________。
(2)甲醛(H2C=O)分子碳原子的杂化方式为________用价层电子对互斥理论推断甲醛中H—C—H的键角________120o(填 “>”“<”或“=”)。
(3)科学家通过X射线探明,KCl、MgO、CaO的晶体结构与NaCl的晶体结构相似(图a所示)。KCl、CaO、MgO三种离子晶体熔点从高到低的顺序是________。
设MgO晶胞的边长为acm,则MgO的密度是________g·cm-3(只要求列算式。阿伏伽德罗常数为NA)。
(5)某配合物的分子结构如图b所示,其分子内不含有________(填字母)。
A.离子键
B.共价键
C.金属键
D.配位键
E.氢键
F.Π键
正确答案
(1)N>O>S
(2)sp2;<
(3)MgO>CaO>KCl
(4)160/a3 NA
(5)AC
解析
(1)根据同周期同主族元素性质递变规律判断,同一周期由左向右元素原子的第一电离能呈递增趋势,但氮原子2p轨道为半充满状态,第一电离能比相邻的元素都大;同主族由上到下元素原子的第一电离能逐渐减小,N、O、S三种元素的第一电离能从大到小的顺序为N>O>S。
(2)甲醛(H 2 C=O)分子碳原子的杂化方式为sp2;甲醛(H 2 C=O)分子中氧原子上含有两对孤对电子,对成键电子对有排斥作用,甲醛中H—C—H的键角<120o 。
(3)对于结构相似的离子晶体,晶格能越大晶体的熔点越高;晶格能的高低取决于离子半径和离子所带的电荷,离子半径越小,所带电荷越多,晶格能越大,熔点越高;则KCl、CaO、MgO三种离子晶体熔点从高到低的顺序是MgO>CaO>KCl。
(4)根据MgO晶胞结构利用切割法分析知,1mol晶胞中含有4molMgO,质量为160g,晶胞的边长为acm,则1mol晶胞的体积为a3NAcm3则MgO的密度是160/a3NAg·cm-3 。
(5)根据配合物的分子结构判断,其分子内不含有离子键和金属键,选AC。
知识点
铜的化合物是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。请回答下列问题:
(1)与铜同周期的所有元素的基态原子中,未成对电子数与铜相同的元素有________种。Cu+的电子排布式是________。
(2)配离子[Cu(NH3)4(H2O)2]2+的Cu(Ⅱ)的配位数为________,该微粒含有的微粒间的作用力类型有________(填字母);
A.配位键
B.离子键
C.极性共价键
D.氢键
E.金属键
F.σ键
H、N、O三种元素的电负性由大到小的顺序是________。
(3)EDTA(
(4)CuCl的晶胞结构如图所示,其中Cl-的配位数(即与Cl-最近距离的Cu+的个数)为________。
正确答案
(1)3;1s22s22p63s23p63d104s0
(2)6;ACF;ONH
(3)sp2 、sp3
(4)4
解析
略。
知识点
氮族元素化合物在医药、纳米材料制备中应用广泛。
40.P元素的基态电子电子排布式为
41.白磷的分子式为P4,其结构如下图所示,科学家目前合成了 N4分子, N 原子的杂化轨道类型是 ,N—N—N 键的键角为 ;
42.N、P、As原子的第一电离能由大到小的顺序为 。
44.立方氮化硼晶体的结构如下图所示:N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是 ;立方砷化镓晶体的晶胞边长为a pm,则其密度为 g·cm-3 (用含a的式子表示,设NA为阿伏加德罗常数的值)。
正确答案
1s22s22p63s23p3 或Ne3s23p3
解析
P原子核外有15个电子,根据构造原理书写基态P原子核外电子排布式为1s22s22p63s23p3
故答案为:1s22s22p63s23p3
考查方向
解题思路
P原子核外有15个电子,根据构造原理书写基态P原子核外电子排布式
易错点
书写电子排布式的方法不掌握
正确答案
sp3 60°
解析
N4分子中每个N原子价层电子对个数是4且含有一对孤对电子对,根据价层电子对互斥理论判断N原子杂化方式为sp3;该分子结构和白琳分子结构相同,为正四面体结构,键角为60度。
考查方向
解题思路
N4分子中每个N原子价层电子对个数是4且含有一对孤对电子对,根据价层电子对互斥理论判断N原子杂化方式;该分子结构和白琳分子结构相同,为正四面体结构
易错点
杂化类型不会判断
正确答案
N>P>As
HNO3 NO3— V形
解析
同主族元素,元素第一电离能随着原子序数增大而减小,故第一电离能N>P>As
故答案为:N>P>As
[来源:学.科.网Z.X43.HNO3、HNO2是氮元素形成的含氧酸,酸性较强的是 ,酸根中没有孤对电子的是 ,NO2—空间构型是 。
同一非金属元素形成的含氧酸中,非羟基O原子个数越多该酸酸性越强,硝酸分子中非羟基氧原子个数大于亚硝酸,所以硝酸酸性较强,硝酸根离子中孤店子对个数=

故答案为HNO3 NO3— V形
考查方向
解题思路
同主族元素,元素第一电离能随着原子序数增大而减小;
同一非金属元素形成的含氧酸中,非羟基O原子个数越多该酸酸性越强,硝酸分子中非羟基氧原子个数大于亚硝酸,所以硝酸酸性较强,硝酸根离子中孤店子对个数=

易错点
第一电离能变化规律未掌握
不会通过计算发法推断出空间构型
正确答案
氮化硼(或BN) 5.8×1032/NA·a3
解析
立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径小,共价键越强,晶体熔点越高,故氮化硼熔点更高;晶胞中 As、Ga原子数目均为4,晶胞质量为
故答案为:5.8×1032/NA·a3
考查方向
解题思路
立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径小,共价键越强,晶体熔点越高,根据均摊法计算晶胞中As、Ga原子数目,表示出晶胞质量,根据密度共识进行计算
易错点
不会利用密度公式进行晶胞的基本计算
扫码查看完整答案与解析






















