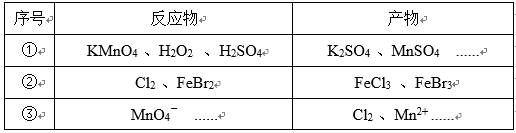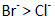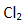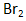- 化学反应原理
- 共2396题
向盛KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):
(2)整个过程中的还原剂是______________________________________。
(3)KI换成KBr,则CCl4层变为____________色;继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是____________________________________。
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000k9,若用KI与 Cl2反应制KIO3,至少需要消耗Cl2___________________L(标准状况,保留2位小数)。
正确答案
(1)I2 + 5Cl2 + 6H2O→2HIO3 + 10HCl
(2) KI、I2
(3)红棕 HBrO3>Cl2>HIO3
(4) 10.58
解析
略
知识点
根据表中信息判断,下列选项不正确的是
正确答案
解析
略
知识点
实验:
①向2 mL 1 mol·L-1 NaBr溶液中通入少量氯气,溶液变为黄色;
②取①所得溶液滴加到淀粉KI试纸上,试纸变蓝;
③向①所得溶液继续通入氯气,溶液由黄色变成橙色。
下列分析不正确的是
正确答案
解析
略
知识点
根据下列实验现象,所得结论不正确的是
正确答案
解析
略
知识点
NaNO2有像食盐一样的外观和咸味,它可将正常的血红蛋白变为高铁血红蛋白,使血红蛋白中的铁元素由二价变为三价,失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂
(1)下列说法正确的是 。
A、解毒剂美蓝应该具有氧化性
B、中毒时亚硝酸盐发生氧化反应
C、解毒时高铁血红蛋白被还原
D、中毒过程中血红蛋白显氧化性
(2)、已知NaNO2 能发生如下反应:NaNO2 + HI → NO + I2 + NaI + H2O
从上述反应推知 。
A、氧化性:I2>NaNO2
B、氧化性:NaNO2>HI
C、还原性:HI>NO
D、还原性:I2>HI
当有0.75mol HI被氧化时,在标准状况下产生气体的体积是_______L。
(3)根据上述反应可用试纸和生活中常见的物质进行实验,鉴别NaNO2和NaCl ,现供选用的物质有①白酒、②碘化钾淀粉试纸、③淀粉、④白糖、⑤食醋,进行本实验时,可以选用的物质至少有 (填序号)。
(4) 某工厂的废液中含有2%~5%的NaNO2直接排放会造成污染,下列试剂中①NaCl、②NH4Cl、③HNO3、④浓H2SO4,能使NaNO2转化为N2的是 (填序号)。
正确答案
(1)C ;
(2)BC ; 16.8
(3) ②⑤
(4)②
解析
略
知识点
二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式________。
(2)已知:Se+2H2SO4(浓)→2SO2↑+SeO2+2H2O
2SO2+SeO2+2H2O→Se+2SO42-+4H+
SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是______。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI+HNO3→Se+I2+KNO3+H2O
②I2+2Na2S2O3→Na2S4O6+2NaI
配平方程式①,标出电子转移的方向和数目。
(4)实验中,准确称量SeO2样品0.1500g,消耗了0.2000 mol/L的Na2S2O3溶液25.00 mL,所测定的样品中SeO2的质量分数为___。
正确答案
(1)Se+2HNO3(浓)→H2SeO3+NO↑+NO2↑ ;
(2)H2SO4(浓)>SeO2>SO2
(3) 
(4)0.925
解析
利用题中信息可知Se与浓HNO3反应,Se被氧化为+4价的H2SeO3,HNO3还原为NO与NO2,利用电子守恒和限定条件(生成NO与NO2的物质的量之比为1:1,即二者计量系数比为1:1)可得方程式。利用氧化性:氧化剂>氧化产物,结合题中方程式可知氧化性:H2SO4(浓)>SeO2>SO2。在反应①I-失电子,转移SeO2,+4价Se得到电子还原为单质Se。利用前面配平的方程式可得关系式:SeO2~2I2~4Na2S2O3,故样品中SeO2的质量分数为:[111g·mol-1×(0.2000mol/L×0.025L)/4]/0.1500g=0.925。
知识点
从石英砂制取并获得高纯硅的主要化学反应如下( )
①SiO2+ 2C
②Si(粗) +2Cl2
③SiCl4 + 2H2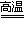

正确答案
解析
略
知识点
已知下列实验事实:①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;②将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝;③向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液。下列判断不正确的是
正确答案
解析
略
知识点
常温下,在下列溶液中发生如下反应①16H++10Z-+2XO4-→2X2++5Z2+8H2O ②2A2+ +B2→2A3++2B- ③2B-+Z2→B2+2Z-由此判断下列说法错误的是
正确答案
解析
略
知识点
“富煤、贫油、少气”是我国能源发展面临的现状。随着能源的日益紧张,发展“煤化工”对我国能源结构的调整具有重要意义。下图是煤化工产业链之一。

(1)已知:




则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= _______kJ/mol。在标准状况下,33.6 L的煤炭合成气与氧气完全反应生成CO2和H2O,反应过程中转移_______mol e-。
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g)
①下列情形能说明上述反应已达到平衡状态的是_______
a.体系压强保持不变
b.密闭容器中CO、H2、CH3OH(g)3种气体共存
c.CH3OH与H2物质的量之比为1:2
d.每消耗1 mol CO的同时生成2molH2
②CO的平衡转化率(α)与温度、压强的关系如右图所示。
A、B两点的平衡常数_______(填“前者”、“后者”或“一样”)大;
达到A、C两点的平衡状态所需的时间tA tC(填“大于”、“小于”或“等于”)。
在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是_______(答出两点即可)。
(3)工作温度650℃的熔融盐燃料电池,是用煤炭气(CO、H2)作负极燃气,空气与CO2的混合气体为正极燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为_______。
正确答案
见解析。
解析
(1)-524.8 ; 3
(2)①a d
②一样 ; 大于
降温、加压、将甲醇从混合体系中分离出来
(3)
知识点
用下列实验装置进行相应实验,能达到实验目的的是( )。
正确答案
解析
略
知识点
已知NaCN溶液呈碱性,(CN)2与卤素单质的性质相似,CN-的还原性介于Br-、I-之间。下列变化不能发生的是
正确答案
解析
略
知识点
下列实验的现象与对应的结论均正确的是
正确答案
解析
略。
知识点
硫元素的含氧酸盐在工业上用途广泛,完成下列填空。
工业上用Na2SO3溶液处理工业尾气中的SO2,下表数据表示反应过程中
(1)简述
(2)已知:Ki1(H2SO3)> Ki(HAc) > Ki2(H2SO3) > Ki2(H2CO3),要使NaHSO3溶液中c(Na+):c(HSO3-)接近1:1,可在溶液中加入少量____________。
a.H2SO3溶液 b.NaOH溶液 c.冰醋酸 d.Na2CO3
(3)实验室通过低温电解KHSO4溶液制备过二硫酸钾K2S2O8,写出熔融KHSO4的电离方程式:__________________________________________。
(4)S2O82-有强氧化性,还原产物为SO42-,硫酸锰(MnSO4)和过硫酸钾(K2S2O8)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。书写此反应的化学方程式:_________。
(5)已知:S2O32-有较强的还原性,实验室可用I-测定K2S2O8样品的纯度:反应方程式为:
S2O82-+2I-→2SO42-+I2 ……① I2+2S2O32-→2I-+S4O62- ……②
S2O82-、S4O62-、I2氧化性强弱顺序:__________________________。
(6)K2S2O8是偏氟乙烯(CH2=CF2)聚合的引发剂,偏氟乙烯由CH3—CClF2气体脱去HCl制得,生成0.5 mol偏氟乙烯气体要吸收54 kJ的热,写出反应的热化学方程式_______。
正确答案
(1)HSO3-的电离程度与SO32-的水解程度相近 0.2 mol/L
(2) a c
(3)KHSO4 →K+ + HSO4-
(4)5K2S2O8 + 2MnSO4 + 8H2O → 4K2SO4 + 2KMnO4 + 8H2SO4
(5)S2O82- > I2 > S4O62-
(6)CH3—CClF2(g) → CH2=CF2(g) + HCl(g)–108kJ
解析
略
知识点
下列进行性质比较的实验,不合理的是
正确答案
解析
略
知识点
扫码查看完整答案与解析