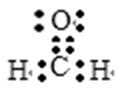- 物质结构与性质
- 共518题
helicopter
正确答案
interval
正确答案
下表中实线表示目前元素周期表七个周期的部分边界。
请按要求回答下列问题:
7.请在上表中用实线画出从第三周期到第六周期金属和非金属的交界线。
8.元素
9.由元素
10.设计实验证明单质的还原性:
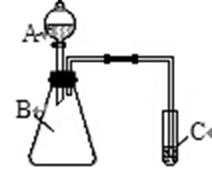
若利用右图装置实验,证明元素的非金属性:
__________________________________________________;但需在C的试管口处堵一块蘸有_____________溶液的棉花吸收尾气。
11.元素
欲将标准状况下8.96 L M(由元素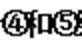
正确答案
考查方向
本小题考查了元素周期表的结构
解题思路
属于识记内容,记住铝和硅的位置。
教师点评
本题考查元素周期表结构,难度小,高考中出现概率低。
正确答案
H2O>H2S>PH3
考查方向
本题考查了氢化物的稳定性,元素周期律等知识。
解题思路
找出
教师点评
本题考查了氢化物的稳定性,元素周期律等知识。元素周期律在高考属于必考点,考查的形式多样,出现频率高。
正确答案
考查方向
本题考查了电子式等知识点。
解题思路
根据八电子稳定结构尝试写出最简单的结构。
教师点评
本题考查电子式的知识点,在全国卷出现概率低。
正确答案
2Na+2H2O=2NaOH+H2↑
S2-+Cl2=2Cl-+S↓
氢氧化钠溶液
考查方向
本题考查了实验探究元素周期律、氯气的实验室制备等知识点。
解题思路
可以利用还原性强的置换出还原性弱的,及金属活动性顺序。2Na+2H2O=2NaOH+H2↑
根据实验仪器和试剂可知是AB装置是制备氯气的装置,因此本题的思路是利用单质氧化性强弱判断非金属强弱,C中含有S2-被Cl2置换即可。最后一空为氯气的尾气吸收装置。
教师点评
本题通过实验探究元素周期律间接考查了化学方程式和离子方程式的书写,和元素化合物的性质及气体的制备等知识,内容比较基础,高考中出现概率中等。
正确答案
HNO3 = H++NO3-
硝酸铵属于强电解质,在水中完全电离,其中NH4+水解而使溶液显酸性
解析
第三问:n(NO)=8.96L/22.4L.mol=0.4mol
4NO+3O2+2H2O=4HNO3
4 3
0.4 x=0.3mol N=1.806x1023
考查方向
本题考查了氮元素及其化合物的知识点及盐类的水解,强电解质的电离方程式等知识点
解题思路
略(简单,识记内容)
教师点评
本题考查了NO与氧气与水完全反应的问题,在高考中出现的频率低。
下列有关化学键的叙述,正确的是
正确答案
解析
离子化合物中一定含有离子键,A正确;只有单原子分子单质分子中不含化学键,B错误;C
知识点
科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:
下列有关说法正确的是
正确答案
解析
本题以储氢新方法为背景,综合考查化学反应与能量的关系、化学键的类型、氧化还原反应、气体摩尔体积及其使用条件等知识,同时考查考生对接受、吸收、整合化学信息的能力。化学反应过程中一定伴随着能量的变化,A选项错误;NaHCO3、HCOONa均为离子化合物,含有离子键,HCO3-、HCOO- 中的原子间均以极性共价键结合,B选项正确;NaHCO3和HCOONa中C元素的化合价分别为+4和+2,储氢过程中NaHCO3被还原,C选项错误;D选项没有指明气体所处状态为标准状态(0℃,101kPa),故错误。
知识点
科学家最近研制出可望成为高效火箭推进剂N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是
正确答案
解析
本题考查分子结构、氧化还原反应以及阿伏伽德罗常熟等知识。
A错在N-O键为极性键;

知识点


正确答案
解析
略
知识点
氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是
正确答案
解析
本题考查化学键、物质结构。意在考查考生对晶体类型和化学键等概念的掌握。AlON与石英(SiO2)均为原子晶体,所含化学键均为共价键,故A、B项正确;Al2O3是离子晶体,晶体中含离子键,不含共价键,故C项正确、D项错误。
知识点
我国科学家研制出一中催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:HCHO+O2
正确答案
解析
A、该反应在室温下可以进行,故该反应为放热反应,错误;B、二氧化碳结构为


知识点
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如下图所示)。已知该分子中N-N-N键角都是108.1°,下列有关N(NO2) 3的说法正确的是 ( )
正确答案
解析
略
知识点
下列判断正确的是
正确答案
解析
略
知识点
(1)依据第2周期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。
(2)NF3可由NH3和F2在Cu催化剂存在下反应直接得到:
2NH3+3F2 
①上述化学方程式中的5种物质所属的晶体类型有 (填序号)。
a。离子晶体 b。分子晶体 c,原子晶体 d。金属晶体
②基态铜原子的核外电子排布式为 。
(3)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
①晶体Q中各种微粒间的作用力不涉及 (填序号)。
a.离子键
b.共价键
c.配位键
d.金属键
e.氢键
f.范德华力
②R中阳离子的空间构型为 ,阴离子的中心原子轨道采用 杂化。
(4)已知苯酚(

正确答案
见解析。
解析
(1)
(2)①a、b、d ②1s22s22p63s23p63d104s1或[Ar]3d104s1
(3)①a、d ②三角锥型 sp3
(4)< 
知识点
以下结论可靠的是
正确答案
解析
略
知识点
前四周期原子序数依次增大的元素A,B,C,D中, A和B的价电子层中未成对电子均只有1个,平且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。
回答下列问题:
(1) D2+的价层电子排布图为_______。
(2) 四种元素中第一电离最小的是________,
电负性最大的是________。(填元素符号)
(3) A、B和D三种元素责成的一个化合物的晶胞如图所示。
① 该化合物的化学式为_________;D的配位数为_______;
② 列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,期中化学键的类型有_____;该化合物中存在一个复杂离子,该离子的化学式为_______,配位体是____。
正确答案
答案:
(1)
(2)K F
(3)①K2NiF4; 6
②=3.4
(4)离子键、配位键;[FeF6]3-;
解析
略
知识点
周期表前四周期的元素a、b、c、d、e,原子序数依次增大。A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能最大的是 (填元素符号),e的价层电子轨道示意图为 。
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;分子中既含有极性共价键,又含有非极性共价键的化合物是 (填化学式,写两种)。
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是 ;酸根呈三角锥结构的酸是 。(填化学式)
(4)c和e形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 。
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈轴向狭长的八面体结构(如图2所示)。该化合物中阴离子为 ,阳离子中存在的化学键类型有 ;该化合物加热时首先失去的组分是 ,判断理由是 。
正确答案
(1)N
(2) 

(3)

(4) +1
(5)




解析
略
知识点
扫码查看完整答案与解析