- 物质结构与性质
- 共518题
13.根据下列实验操作和现象所得到的结论正确的是( )
正确答案
AC
知识点
11.如图装置(不考虑试剂倒吸)可用于收集气体并验证其某些化学性质,你认为正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
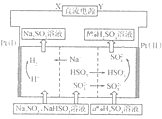
12.用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如图所示。则下列有关说法中不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.下列实验方案中,能测定Na2CO3和NaHCO3混合物中NaHCO3质量分数的是( )
①取a克混合物充分加热,减重b克
②取a克混合物与足量稀盐酸充分反应,加热.蒸干.灼烧,得b克固体
③取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,碱石灰增重b克
④取a克混合物与足量Ba(OH)2溶液充分反应,过滤.洗涤.烘干,得b克固体
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
18.为了除去FeSO4溶液中的Fe3+,可用加入纯铁屑,但此法很费时;现有一种方法是在蒸馏水沸腾时加入粉未状的绿矾(少量多次),搅拌,直到观察到有褐色沉淀产生即可停止加入药品,煮沸1~2分钟,趁热过滤,密封保存所得的FeSO4溶液,此法的原理是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.对下列化学用语的理解和描述均正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.如图,a、b是两根碳棒。以下叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
18.从下列事实所得出的相应结论正确的是( )
正确答案
解析
每小题有一个或两个正确选项,只有一个正确选项的,多选不给分,有两个正确选项的,选对一个给2分,选错一个该小题不给分。
知识点
13、若往20ml 0.01mol/LCH3COOH溶液中逐滴加入一定浓度的烧碱溶液,测的溶液的温度变化如图所示,下列有关说法正确的是
正确答案
解析
A. c点出溶液即为醋酸钠溶液,而醋酸钠溶液显碱性。
B. B点处加入的碱的量为醋酸总量的一半的时候溶液为醋酸钠与醋酸的混合溶液,溶液中钠离子的物质的量是溶液中醋酸与醋酸钠的物质的量的一半,B正确。
C. b点是醋酸钠与醋酸的混合溶液,c点是醋酸钠溶液,d点是醋酸钠与氢氧化钠混合溶液,当溶液中只有醋酸钠时,水的电离程度最大,而当溶液中有酸,例如醋酸,或者有碱例如氢氧化钠存在时会抑制水的电离。
D. 图示所反应的只是溶液整体温度的变化,该反应的中和热一直在增大,达到c点之后中和反应进行完全,不再有热量放出。
考查方向
解题思路
A. c点处,温度最高电离常数与电离程度最大,此时酸碱完全中和,之后一直延续到d点,温度任然比a点高的原因是,散热需要一个过程。
易错点
B点处加入的碱的量为醋酸总量的一半的时候溶液为醋酸钠与醋酸的混合溶液
知识点
4.下列各组离子,能在指定溶液中共存的是( )
①无色溶液中:K+、Cl﹣、Na+、HCO3﹣、OH﹣
②使pH试纸变深蓝色的溶液中:K+、CO32﹣、Na+、AlO2﹣
③水电离的c(H+)=10﹣12mol•L﹣1的溶液中:ClO﹣、NO3﹣、NH4+、SO32﹣
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl﹣、Na+、SO42﹣
⑤使甲基橙变红的溶液中:MnO4﹣、NO3﹣、SO42﹣、Na+、Fe3+
⑥pH=0的溶液中:Fe2+、Al3+、NO3﹣、Cl﹣、SO32﹣.
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.NA表示阿伏加德罗常数的值。下列判断中,正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.已知NH4++AlO2-+2H2O=Al(OH)3↓+NH3·H2O。向含有等物质的量的NH4Cl、AlCl3和HCl混合溶液中慢慢滴加NaOH溶液至过量,并不断搅拌,可能发生以下离子反应:
①H++OH-=H2O;
②Al(OH)3+OH-=AlO2-+2H2O;
③Al3++3OH-=Al(OH)3↓;
④NH4++OH-=NH3·H2O;
⑤NH4++AlO2-+2H2O=Al(OH)3↓+NH3·H2O。
其正确的离子反应顺序是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式。SnSO4是一种重要的硫酸盐,广泛应用于镀锡工业,其制备路线如下:
回答下列问题:
(1) SnCl2用盐酸而不用水直接溶解的原因是:______________________。
加入锡粉的作用是:____________________.
(2) 反应I生成的沉淀为SnO,写出该反应的化学方程式:
(3) 检验沉淀已经“洗涤”干净的操作是:______________________。
(4)反应Ⅱ硫酸的作用之一是控制溶液的pH。若溶液中c(Sn2+)=1.0mol·L—1,则室温下应控制溶液pH_________________。(已知:Ksp[Sn
(5)酸性条件下,SnSO4还可用作双氧水的去除剂,试写出所发生反应的离子方程式:_________________。
(6)潮湿环境中,镀锡铜即使锡层破损也能防止形成铜绿,请结合有关的原理解释其原因:
___________________________。
正确答案
(1)抑制Sn2+水解, 防止Sn2+被氧化
(2)SnCl2 + Na2CO3 = SnO + CO2↑+2NaCl
(3)取少量最后
(4)小于1
(5)Sn2+ + H2O2 + 2H+ = Sn4+ + 2H2O
(6)潮湿环境中,Sn与Cu构成原电池,Sn作为负极,保护正极Cu不被氧化
解析
解析已在路上飞奔,马上就到!
知识点
11.已知: 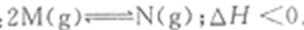
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析