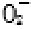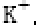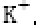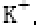- 物质结构与性质
- 共518题
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是
正确答案
解析
Y2-与Z+核外电子层结构相同,则Y的最外层电子数为6,Z的最外层电子数为1.则Y可能为O、S元素,Z可能为H、Li、Na元素。X、Y、Z原子序数之和为20,则Y只可能为O,由此可推得X为H,Z为Na。
知识点
亚硝酸钠(NaNO2)易溶于水,微溶于乙醚,是常用的食品发色剂
(1)第一电离能:N ___O(填“<”、“>”或“=”);NO2-的空间构型为____
(2)亚硝酸钠在3200C会分解生成氧化钠、一氧化二氮等物质,该反应的化学方程式为____
(3)亚硝酸钠是亚硝酸的钠盐。HNO2的结构如图所示,则HNO2分子中有___个
HNO2的酸性比HN03弱是因为_____
(4)亚硝基钻钠

①基态
②用亚硝酸钻钠检验f的离子方程式是
③金属钻的堆积方式如图所示,若一个钻原子的半径为,,则晶胞的体积V(晶胞)=__
正确答案
(1)>(1分);V型或角形(1分)
(2)
(3)3(2分)
(4)
解析
略
知识点
Ⅰ.第28届国际地质大会提供的资料显示,海底有大量的天然气水合物,可满足人类 1000年的能源需要。天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子。根据上述信息,完成下面两题:
(1)下列关于天然气水合物中两种分子描述正确的是
A.两种都是极性分子 B.两种都是非极性分子
C.H2O是极性分子,CH4是非极性分子 D.其中氧原子和碳原子的杂化方式分别为sp2和sp3
E.其中氧原子和碳原子的杂化方式均为sp3
(2)晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为
II、A、B、C、D是短周期元素,它们的离子具有相同的电子层结构,且半径依次减小。A与D的化合物X既能与盐酸反应,又能与NaOH溶液反应;B、C组成典型的离子化合物Y,其晶体结构类似于NaCl晶体;A与C以原子个数之比1︰1组成化合物Z。
(3)写出Z的电子式
(4)C元素焰色反应的颜色为 试从原子结构的角度解释其原因
(5)B、C、D可组成离子化合物CmDBn,其晶体结构单元如右图所示。阳离子Cx+(○表示)位于正方体的棱的中点和正方体内部(内部有9个○,1个位于体心,另8个位于大正方体被等分为8个小正方体后的体心);阴离子DBnmx-(●表示)位于该正方体的顶点和面心。则:x= 、m= 、n= 。已知该晶体的密度为a g/cm3 ,则该晶体
正确答案
中阳离子间的最近距离为
(1)CE
(2)CH4·8H2O或6CH4·48H2O
(3)
(4)黄色;在加热的条件下钠原子的核外电子吸收能量,电子从基态跃迁到激发态,电子处于激发态不稳定又重新跃迁到基态,在此过程中以光波的形式释放能量。
(5)1;3;6;
解析
略
知识点
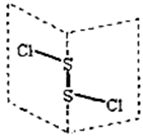
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右下图所示。常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体。下列说法错误的是()
正确答案
解析
略
知识点
下列分子中,属于含有极性键的非极性分子的是
正确答案
解析
略
知识点
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为 ,第一电离能最小的元素是 (填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是 (填化学式),呈现如此递变规律的原因是 。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为 、另一种的晶胞如图二所示,该晶胞的空间利用率为 ,若此晶胞中的棱长为356.6 pm,则此晶胞的密度为 

(4)D元素形成的单质,其晶体的堆积模型为 ,D的醋酸盐晶体局部结构如图
三,该晶体中含有的化学键是 (填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到的现象是 。请写出上述过程的离子方程式: 。
正确答案
(1)
(2)
(3)
(4)
(5)
解析
略
知识点
7. 碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如下图。下列有关该物质的说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.下列物质中属于离子晶体且含有极性键的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
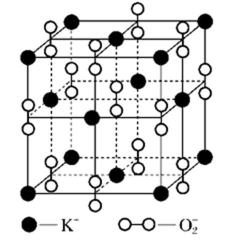
13.高温下,超氧化钾(KO2)晶体结构与NaCl相似,其晶体结构的一个基本重复单元如图所示,已知晶体中氧的化合价可看作部分为0价,部分为-2价。则下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
氮族元素化合物在医药、纳米材料制备中应用广泛。
40.P元素的基态电子电子排布式为
41.白磷的分子式为P4,其结构如下图所示,科学家目前合成了 N4分子, N 原子的杂化轨道类型是 ,N—N—N 键的键角为 ;
42.N、P、As原子的第一电离能由大到小的顺序为 。
44.立方氮化硼晶体的结构如下图所示:N与As是同族元素,B与Ga是同族元素,立方砷化镓晶体与立方氮化硼晶体结构类似,两种晶体中熔点较高的是 ;立方砷化镓晶体的晶胞边长为a pm,则其密度为 g·cm-3 (用含a的式子表示,设NA为阿伏加德罗常数的值)。
正确答案
1s22s22p63s23p3 或Ne3s23p3
解析
P原子核外有15个电子,根据构造原理书写基态P原子核外电子排布式为1s22s22p63s23p3
故答案为:1s22s22p63s23p3
考查方向
解题思路
P原子核外有15个电子,根据构造原理书写基态P原子核外电子排布式
易错点
书写电子排布式的方法不掌握
正确答案
sp3 60°
解析
N4分子中每个N原子价层电子对个数是4且含有一对孤对电子对,根据价层电子对互斥理论判断N原子杂化方式为sp3;该分子结构和白琳分子结构相同,为正四面体结构,键角为60度。
考查方向
解题思路
N4分子中每个N原子价层电子对个数是4且含有一对孤对电子对,根据价层电子对互斥理论判断N原子杂化方式;该分子结构和白琳分子结构相同,为正四面体结构
易错点
杂化类型不会判断
正确答案
N>P>As
HNO3 NO3— V形
解析
同主族元素,元素第一电离能随着原子序数增大而减小,故第一电离能N>P>As
故答案为:N>P>As
[来源:学.科.网Z.X43.HNO3、HNO2是氮元素形成的含氧酸,酸性较强的是 ,酸根中没有孤对电子的是 ,NO2—空间构型是 。
同一非金属元素形成的含氧酸中,非羟基O原子个数越多该酸酸性越强,硝酸分子中非羟基氧原子个数大于亚硝酸,所以硝酸酸性较强,硝酸根离子中孤店子对个数=

故答案为HNO3 NO3— V形
考查方向
解题思路
同主族元素,元素第一电离能随着原子序数增大而减小;
同一非金属元素形成的含氧酸中,非羟基O原子个数越多该酸酸性越强,硝酸分子中非羟基氧原子个数大于亚硝酸,所以硝酸酸性较强,硝酸根离子中孤店子对个数=

易错点
第一电离能变化规律未掌握
不会通过计算发法推断出空间构型
正确答案
氮化硼(或BN) 5.8×1032/NA·a3
解析
立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径小,共价键越强,晶体熔点越高,故氮化硼熔点更高;晶胞中 As、Ga原子数目均为4,晶胞质量为
故答案为:5.8×1032/NA·a3
考查方向
解题思路
立方砷化镓晶体与立方氮化硼晶体结构类似,均属于原子晶体,原子半径小,共价键越强,晶体熔点越高,根据均摊法计算晶胞中As、Ga原子数目,表示出晶胞质量,根据密度共识进行计算
易错点
不会利用密度公式进行晶胞的基本计算
3.某晶体中含有极性键,关于该晶体的说法错误的是( )
正确答案
解析
含有极性键的晶体可能是原子晶体,如二氧化硅中含有Si﹣O极性键,其熔沸点很高, 故A错误;
含有极性键的物质至少含有2种元素,属于化合物,不可能是单质,故B正确;
有机物中含有极性键,如甲烷中含有C﹣H极性键,故C正确;
离子晶体中也可能含有极性键,如NaOH中含有O﹣H极性键,故D正确.
考查方向
解题思路
一般不同非金属元素之间易形成极性键,已知某晶体中含有极性键,则该晶体为化合物,可能是离子化合物、共价化合物,结合不同类型晶体的性质分析.
易错点
本题考查了极性键、晶体的类型,题目难度不大,注意离子晶体中一定含有离子键可能含有共价键,题目难度不大,注意利用举例法分析.
知识点
374℃、22.1Mpa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH-,由此可知超临界水
正确答案
解析
略
知识点
PH3一种无色剧毒气体,其分子结构和NH3相似,但P-H键键能比N-H键键能低。下列判断错误的是
正确答案
解析
本题考查化学键、分子构型。意在考查考生分子结构的知识。PH3同NH3构型相同,因中心原子上有一对孤电子对,均为三角锥形,属于极性分子,故A、B项正确;PH3的沸点NH3,是因为NH3分子间存在氢键,C项错误;PH3的稳定性低于NH3,是因为N-H键键能高,D项正确。
知识点
8.下列叙述不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右下图所示。常温下,S2Cl2遇水易与水发生反应,并产生能使品红褪色的气体。下列说法错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析