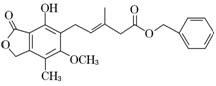- 物质结构与性质
- 共518题
10.四种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子核质子数之比为1:2,X和Y的电子数之差为4。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4.下列叙述不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.下列离子方程式正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.单斜硫和正交硫转化为二氧化硫的能量变化如图所示。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.一氧化碳是一种用途广泛的化工基础原料。
(l)在高温下CO可将SO2还原为单质硫。已知:
请写出CO还原SO2的热化学方程式___________________________。
(2)工业土用一氧化碳制取氢气的反应为:
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图
电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是________(填“正极”或“负极”),c电极的反应方程式为_____________________________。若用该电池电解精炼铜(杂质含有Ag和Fe),粗铜应该接此电源的________极(填“c”或“d”),反应过程中析出精铜64g,则上述CH3OH燃料电池,消耗的O2在标况下的体积为________L。
正确答案
(1)
(2) 75% 
(3)负极 
解析
解析已在路上飞奔,马上就到!
知识点
11.短周期主族元素X、Y、Z在元素周期表中的相对位置如图,下列推论合理的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
30.化学是一门以实验为主的科学,化学实验是学习探究物质性质的基本方法之一。
(1)下列有关说法中正确的有_________
①将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH.若前者的pH小于后者,则H2SO3酸性强于H2CO3
②用瓷坩埚高温熔融NaOH固体
③加入浓NaOH溶液,加热产生使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定含有NH4+
④向溶液中加入少量双氧水,再加几漓KSCN溶液后溶液变红,则原溶液中。定含有Fe2+
⑤配制Fe(NO3)2溶液时通常加少量HNO3酸化,减小其水解程度
⑥将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入少量紫色石蕊试液,石蕊褪色后加热也能恢复原色
⑦配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
⑧酸碱滴定时,若加入待测液前用待测液润洗锥形瓶,将导致测定结果偏高
⑨制备AICl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法;电解AICl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、AI
⑩用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗上口放出;NaC1溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热
(2)甲、乙是同主族非金属元素组成的单质,乙通常状况下是深红棕色液体。X、Y、Z是化合物。X溶液呈淡绿色,Y、Z的溶液都能使KSCN溶液变红。它们之间有如图所示转化关系。
①将Y的饱和溶液滴入沸水中,继续加热可得红褐色液体。此液体不具有的性质是________。
A.光束通过该液体时形成光雾光亮的“通路”
B.插入电极通过直流电后,有一极附近液体颜色加深
C.向该液体中加入硝酸银溶液,无沉淀产生
D.将该液体加热蒸干、灼烧后,有氧化物生成
E.向红褐色液体中逐滴加入稀硫酸,先有红褐色沉淀,后沉淀溶解
②单质甲、乙和Y溶液中的阳离子氧化性由强到弱的顺序为:___________(用化学式表示)少量单质甲通入X溶液中发生的离子方程式为_______________________。
③利用电解饱和食盐水制氯气和氢气,并检验氯气的氧化性和测定产生氢气的体积。试按下图所给仪器,设计一套能完成以上实验目的的装置,仪器接口的正确连接顺序是:
A接__________,__________接__________;B接__________,__________接__________。
写出通入C后,烧杯中所发生的离子反应方程式_________________________________,
若装入的饱和食盐水为500mL,接通电源一段时间,停止通电后,测得氢气为560mL(标准状况)。将U形管内的溶液混合均匀,其pH约为____。(假设电解前后溶液体积变化可忽略不计,产生的气体全部逸出)
正确答案
(1)③⑧⑩
(2)
①C
②G;F;H;D;E;C;
解析
解析已在路上飞奔,马上就到!
知识点
3.用惰性电极电解某溶液时,发现两极只有H2和O2生成,若电解前后温度变化忽略不计,则电解一段时间后,下列有关溶液的叙述正确的是( )
①该溶液的pH可能增大
②该溶液的pH可能减小
③该溶液的pH可能不变
④该溶液的浓度可能增大
⑤该溶液的浓度可能不变
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.可逆反应:3A
①B和C可能都是固体
②B和C一定都是气体
③若C为固体,则B一定是气体
④B和C可能都是气体
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.下列关于实验的描述中,正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
22.下列各项表述与示意图一致的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
20.电化学原理在医学医疗中有重要应用。
(1)碘可用作心脏起搏器电—锂碘电池的材料。该电池反应如下:
则△H=_____________________;碘电极作为该电池的_______极。
(2)人工肾脏可采用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],其原理如图所示。请回答下列问题:
①直流电的负极为___________(填“A”或“B”);
②阳极室中发生的反应依次为______________________、_______________________;
③电解结束后,阴极室溶液的pH与电解前相比将_____________(填“增大”、“减小”或“不变”);若两极共收集到气体13.44L(标准状况),则除去的尿素为___________g(忽略气体的溶解)。
正确答案
(1)
(2)①B
②
③不变 7.2
解析
解析已在路上飞奔,马上就到!
知识点
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题作答。如果多做,则每学科按所做的第一题计分。
36. [选修2—化学与技术]略
37. [选修3—物质结构与性质]
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的 一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未 成对电子;Q原子s能级与P能级电子数相等;R单质是制造各种计算机、微电子产品 的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有_________种不同运动状态的电子,T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)由X、Y、Z形成的离子


(4)Z与R能形成化合物甲,1 mol甲中含________mol化学键,甲与氢氟酸反应,生成 物的分子空间构型分别为________________________
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为________________
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为________________________
(7)X单质的晶胞如右图所示,一个X晶胞中有________________个X原子;若X晶体的密度为

38.[选修5—有机化学基础]
有机物A〜M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与


请回答:
(1)B、F的结构简式分别为____________、____________
(2)反应①〜⑦中,属于消去反应的是________ (填反应序号)。
(3)D发生银镜反应的化学方程式为_______________________;反应⑦的化学方程式为________________________
(4)A的相对分子质量在180〜260之间,从以上转化中不能确认A中的某一官能团,确定该官能团的实验步骤和现象为________________________________________
(5)符合下列条件的F的同,分异构体共有________种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6
36.请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题作答。如果多做,则每学科按所做的第一题计分。36. [选修2—化学与技术]略37. [选修3—物质结构与性质]
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的 一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未 成对电子;Q原子s能级与P能级电子数相等;R单质是制造各种计算机、微电子产品 的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有_________种不同运动状态的电子,T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类 型为________________
(4)Z与R能形成化合物甲,1 mol甲中含________mol化学键,甲与氢氟酸反应,生成 物的分子空间构型分别为________________________
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为________________
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为________________________
(7)X单质的晶胞如右图所示,一个X晶胞中有________________个X原子;若X晶体的密度为p g/cm3,阿伏加德罗常数的值为NA,则晶体中最近 的两个X原子之间的距离为________cm(用代数式表示)
38. [选修5—有机化学基础]
有机物A〜M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应;F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应;M与NaOH溶液反应后的产物,其一氯代物只有一种。
请回答:
(1)B、F的结构简式分别为____________、____________
(2)反应①〜⑦中,属于消去反应的是________ (填反应序号)。
(3)D发生银镜反应的化学方程式为_______________________;反应⑦的化学方程式为________________________
(4) A的相对分子质量在180〜260之间,从以上转化中不能确认A中的某一官能团,确 定该官能团的实验步骤和现象为________________________________________
(5)符合下列条件的F的同,分异构体共有________种。
a.能发生银镜反应 b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6
37.【选修3-物质结构与性质】
(1)7 (1分) 7(1分)
(2)C<O<N(1分,写成C O N不写“<”可给分;写成N>O>C 可给分,但只写成N O C而不写“>”不能给分=
(3)sp杂化(1分) 4 (1分) 正四面体形、V形(或折线形等合理答案即可)(共2分,各1分)
(4)NaF与MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小、电荷数高,晶格能MgF2> NaF,故MgF2的熔点比NaF高。(2分,答案要包括两个要点,一为晶体类型不同,熔点不同;二为同种晶体,晶格能大熔点高。)
(5)Cu2++2 NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3 = [Cu(NH3)4]2+ +2OH- (2分,每个方程式各1分)
(6)8 (2分)

正确答案
36.【选修2-化学与技术】略
正确答案
38.【选修4-有机化学基础】

(2)④(1分)
(3)(3分)
(3分)
(4)取反应①后的混合液少许,向其中加入稀HNO3至酸性,滴加AgNO3溶液,若生成白色沉淀,则A中含氯原子;若生成浅黄色沉淀,则A中含溴原子。(2分)
(5)2(2分)
正确答案
10.有关下图所示化合物的说法不正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
17.已知反应:
①Cl2 + 2KBr = 2KCl + Br2;
②KClO3 + 6HCl = 3Cl2↑+ KCl + 3H2O;
③2KBrO3 + Cl2 = Br2 +2KClO3
下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析