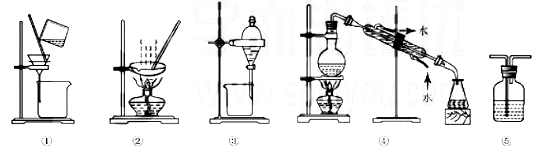- 水的电离
- 共35题
6.常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,下列关于滤液中的离子浓度关系不正确的是( )
正确答案
知识点
10.下列离子方程式正确的是( )
正确答案
解析
A.Mg(OH)2可与FeCl3溶液水解出的氢离子结合而溶于FeCl3溶液,故A错误;B.等物质的量MgCl2、Ba(OH)2和HCl溶液混合后首先发生中和反应,剩余的氢氧化钡再与氯化镁反应生成白色沉淀氢氧化镁,但反应后氯化镁过量,即: Mg2+ + 4OH- + 2H+ = Mg(OH)2↓ + 2H2O,故B正确;C.次氯酸钙溶液中通入足量SO2,反应的离子方程式为:2ClO- +Ca2++2H2O+2SO2=2Cl- +CaSO4↓+4H++SO42-,漂白粉的成分为次氯酸钙和氯化钙;溶液中应有大量的Ca2+,SO42应全部生成CaSO4↓,故C错误;D.熔融状态下Al2O3应写成离子形式,故D错误;
考查方向
解题思路
A.FeCl3溶液水解;B.定量分析混合溶液中离子反应;C.漂白粉的成分为次氯酸钙和氯化钙;D.熔融状态下考虑Al2O3电离;
易错点
C项中易忽略漂白粉中还含有氯化钙成分。
知识点
12.W、X、Y、Z是核外电子层数相同且原子序数依次增大的短周期元素,W、X是金属元素,Y的氢化物为H2Y,Z的某种含氧酸有漂白性.W、X的最高价氧化物对应的水化物可以发生反应生成盐和水.下列判断正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5.下列实验中,所选装置或实验设计合理的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5.某离子反应中共有H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中c(ClO-)随反应进行逐渐减小。下列判断错误的是
正确答案
解析
根据转移电子数守恒正确写出离子反应方程式:3ClO--+2NH4+=3Cl--+N2+3H2O+2H+,其中Cl的化合价降低,ClO—做氧化剂,NH4+做还原剂,所以A错;3 molClO—反应时转移电子6mol,则1molClO—反应时转移电子为2 mol,所以B错;从离子反应方程式中可以看出氧化剂与还原剂的物质的量之比是3:2,所以C对;此反应生成物中产生了H+,所以酸性会增强,所以D错。
考查方向
本题是对氧化还原反应的应用的考查,对氧化还原反应中的氧化剂、还原剂、电子转移情况的综合考查。
解题思路
本题的关键点在题目中c(ClO-)随反应进行逐渐减小,说明ClO-只能作为反应物,生成Cl--,Cl的化合价降低,必定题目中有个粒子的化合价肯定升高,在标出题目所给的物质的化合价不难发现NH4+发生反应生成N2,N的化合价升高,再根据氧化还原反应中转移电子守恒可以解决本题。
易错点
本题没有明确的离子反应方程式,也不确定都有哪些是反应物,哪些物质时生成物,审题不清也会导致此题出现错误。
知识点
扫码查看完整答案与解析