- 电解质溶液的导电性
- 共60题
22.工业生产纯碱的工艺流程示意图如下:
(1)粗盐水中加入沉淀剂A.B以除去杂质制取精盐(沉淀剂A来源于石灰窑厂),写出B的化学式________________。
(2)向过滤出C后的滤液中通入气体NH3和CO2,则气体M是____________________(填化学式),选择的理由是______________。通入气体N后现象是___________
(3)滤液D最主要的成分是________(填写化学式),检验这一成分的阴离子的具体方法是__________________________。
正确答案
(1)Na2CO3
(2)NH3,NH3极易溶于水且显碱性,有利于CO2的溶解。浑浊
(3)NH4Cl,取样,先加稀硝酸酸化,再加入硝酸银溶液,若有白色沉淀产生,则证明该阴离子是氯离子
解析
解析已在路上飞奔,马上就到!
知识点
19.铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾K2FeO4是一种新型、高效、多功能绿色水处理剂,某化学探究小组设计如下方案制备上述两种产品,请回答下列问题:
(1)若A物质为水,一定条件下可得铁的固体氧化物Fe3O4,检验Fe3O4中铁的化合价,应使用的试剂是 _______ (填标号)。
A.稀硫酸
B.稀硝酸
C.KSCN溶液
D.酸性高锰酸钾溶液
(2)在溶液Ⅰ中加入NaClO3,写出其氧化Fe2+的离子方程式 ___________ 。
(3)Fe2O3与KNO3和KOH的混合物加热共融可制得K2FeO4。完成并配平下列化学方程式:

该反应中的氧化剂是 _______,每生成1mol K2FeO4转移______mol电子。
(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I-=2Fe2++I2 I2+2S2O32-=2I-+S4O62-
①写出滴定选用的指示剂_______,滴定终点观察到的现象 ____________ 。
②溶液I中铁元素的总含量为____________g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会__________(填“偏高”、“偏低”、“不变”)。
正确答案
(1)ACD
(2)6Fe2++ClO3—+6H+=6Fe3++Cl—+3H2O
(3) 1、3、4、2K2FeO4、3、2H2O ;KNO3 3
(4)①淀粉 溶液由蓝色变无色且半分钟不变色
②5.6 偏高
解析
解析已在路上飞奔,马上就到!
知识点
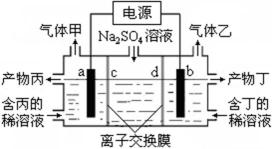
11.工业上常用电解硫酸钠溶液联合生产硫酸和烧碱,生产装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1︰2,以下说法中正确的是
正确答案
解析
电解硫酸钠溶液,阴极为氢离子放电,产生氢气,阳极为氢氧根离子在放电,产生氧气,因气体甲与气体乙的体积比约为1∶2,故气体甲为氧气,气体乙为氢气,产物丙为硫酸溶液,产物丁为氢氧化钠溶液。
A.a极为阳极,与电源的正极相连,A错误;
B.电解硫酸钠溶液,阴极为氢离子放电,产生氢气,阳极为氢氧根离子在放电,产生氧气,因气体甲与气体乙的体积比约为1∶2,故气体甲为氧气,气体乙为氢气,产物丙为硫酸溶液,B正确;
C.离子交换膜c为阴离子交换膜,允许氢氧根离子通过, 离子交换膜d为阳离子交换膜,允许氢离子通过,C错误;
D.b电极反应式:2H++2e-= H2↑,D错误。
故选B。
考查方向
解题思路
电解硫酸钠溶液,阴极为氢离子放电,产生氢气,阳极为氢氧根离子在放电,产生氧气,因气体甲与气体乙的体积比约为1∶2,故气体甲为氧气,气体乙为氢气,产物丙为硫酸溶液,产物丁为氢氧化钠溶液。
A.a极为阳极,与电源的正极相连;
B.电解硫酸钠溶液,阴极为氢离子放电,产生氢气,阳极为氢氧根离子在放电,产生氧气,因气体甲与气体乙的体积比约为1∶2,故气体甲为氧气,气体乙为氢气,产物丙为硫酸溶液;
C.离子交换膜c为阴离子交换膜,允许氢氧根离子通过, 离子交换膜d为阳离子交换膜,允许氢离子通过;
D.b电极反应式:2H++2e-= H2↑。
易错点
本题考查了电解原理,明确离子放电顺序是解本题关键,根据电极反应式分析解答,题目难度不大。
知识点
4.2015年中美专家研制出可在一分钟内完成充电的超常性能铝离子电池,分别以金属铝和石
正确答案
解析
A.放电时为原电池,铝易失去电子为负极、石墨为正极,A正确;
B.充电时的阳极反应发生氧化反应,失去电子,电极反应式为:Cn+ AlCl4--e-= Cn AlCl4,B正确;
C.放电时,铝易失去电子,负极反应为:Al-3e-+7 AlCl4-=4A12C17- ,C正确;
D.放电时为原电池,有机阳离子向正极移动,即石墨电极方向移动,D错误。
故选D。
考查方向
解题思路
A.放电时为原电池,铝易失去电子为负极、石墨为正极;
B.充电时的阳极反应发生氧化反应,失去电子,电极反应式为:Cn+ AlCl4--e-= Cn AlCl4;
C.放电时,铝易失去电子,负极反应为:Al-3e-+7 AlCl4-=4A12C17-;
D.放电时为原电池,有机阳离子向正极移动,即石墨电极方向移动。
易错点
本题考查了充电电池的相关原理,难度一般,解题的关键是掌握原电池和电解池的原理。
知识点
5.下列有关电解质溶液中粒子浓度关系正确的是( )
正确答案
解析
A.醋酸是弱电解质,醋酸溶液稀释C(H+)减小,但由于电离平衡正方向移动,稀释10倍后pH的变化小于1,b<a+1,A错误;
B.根据物料守恒可知:含等物质的量的NaHSO3和Na2SO3的溶液: 2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)],B正确;
C.0.1mol·L-1盐酸与0.2mol·L-1氨水等体积混合:溶液中含有等物质量浓度的NH3·H2O、NH4Cl,氨水的电离大于铵根离子的水解,因此 c(NH4+)>c(Cl-)>C(NH3·H2O)>
D.AgCl的溶度积常数大于AgI

故选B。
考查方向
解题思路
A.加水稀释促进醋酸电离,所以醋酸稀释10倍后,稀释后溶液中氢离子浓度大于原来的1/10;
B.根据物料守恒可知:含等物质的量的NaHSO3和Na2SO3的溶液: 2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)];
C.0.1mol·L-1盐酸与0.2mol·L-1氨水等体积混合:溶液中含有等物质量浓度的NH3·H2O、NH4Cl,氨水的电离大于铵根离子的水解,因此 c(NH4+)>c(Cl-)>C(NH3·H2O)>
D.AgCl的溶度积常数大于AgI

易错点
本题考查弱电解质电离、酸碱混合溶液定性判断、pH简单计算等知识点,明确弱电解质电离特点、pH计算方法等知识点即可解答,知道甲基橙、石蕊、酚酞试液变色范围,题目难度不大。
知识点
扫码查看完整答案与解析